金沢大学病院「同意なき臨床試験」(4)
2018年10月01日
 金沢大学病院
金沢大学病院被告側が証拠として提出した、Kさんの主治医で臨床試験を担当していたA医師の陳述書(2000年8月30日付)には次のように書かれていた(実名で記載されている患者名は「K」と改める)。
私は、(略)症例登録に当たっては、少しでも多くの症例を集積したほうが良いと考え、学内外の病院に出来る限り登録に協力してもらえるようお願いをしてきました。当然、Kに関しても、当初登録したいと考え登録票を作成しました。それが、甲第5号証の1(※筆者注=原告側提出の症例登録票)であります。
しかし、(略)症例登録の最終決定権者である井上教授の判断により、登録不可とされ、最終的には登録に至らなかったため、改めて登録不可とする登録票を作成したものであります。この登録票が、乙第13号証の2(※筆者注=被告側提出の症例登録票)であります。なお、同登録票をいつ作成したか、いつ差し替えたか、また甲第5号証の1をいつどのように処分したかは記憶にありません。なぜなら、北陸GOGに関与する者にとって登録票は、コンピュータに入力するまでのメモ的な意味しか持っていなかったからです。
したがって、Kに係る正式な登録票はということになれば、重複癌であるとした井上教授の判断に基づき作成した、登録を不可とする内容の登録票(乙第13号証の2)であり、それ以前に作成した登録を可とする登録票(甲第5号証の1)は、正式なものを作成する過程でメモ的に作成されたものにすぎず、実際に登録した事実を示すものではありません。
前回述べたように、原告側はKさんの症例登録票と、Kさんを含む被験者の情報を一覧表にした症例登録票を証拠として提出した。一覧表に記載されているKさんの登録日、施設名、担当医師名、患者イニシャル、手術日は、すべてKさんの登録票の記載内容と一致していたが、被告側はこの一覧表についても最終的なものではない、と主張した。2000年9月27日付の被告側準備書面は次のように述べている。
原告らの提出した(略)症例登録一覧表は、北陸GOGの旧事務局であった中外製薬株式会社の学術担当において作成されたもので、とりあえず登録が可能と思われた患者名をリストアップしたものにすぎず、登録が確定した患者を記載したものではない。
症例登録一覧表は、北陸GOG発足当時から、症例の集積に伴い、その状況を確認するため、随時に何回も作成されており、右症例登録一覧表も、ある時点における症例の集積状況を確認するためプリントアウトされた資料の一つである。
したがって、登録症例のみが記載された正式な症例登録一覧表は、あくまでも、学会発表に際し、A医師らが最終的なチェックを行って、登録除外症例等を一覧表から消却し、52症例を記載した乙第18号証である。
乙第18号証というのは、被告側が2000年4月7日付で証拠として提出した文書で、立証趣旨は「北陸GOG卵巣癌症例登録票に基づきコンピューター入力されている北陸GOG登録データを用紙に出力したものを示し、当該登録者は52名であること及び登録者にKが登録されていないことを明らかにする」とされていた。
北陸GOG事務局が1998年3月に中外製薬から金沢大学医学部産婦人科に移転したとの被告側の主張を前提にすれば、被告側が提出したKさんの症例登録票に金沢大学医学部産婦人科のFAX番号が記されていたということは、この症例登録票が1998年3月以降に作成されたことを示すものである、という原告側の指摘について被告側は、①移転の半年以上も前から中外製薬への電話及びFAX登録は中止しており、そのころから実質的な登録業務はA医師らが行っていた、②このため、移行期においては、両方の登録用紙が混在し、区別なく併用して使用されていたため、FAX番号の相違が生じたものである――と説明した。
これに対し原告側は、双方が提出した症例登録票の記載内容を照合し、被告側の主張の矛盾を突いた。
原告側が提出した症例登録一覧表に記載された患者のうち最も後に登録された人の登録日は、1998年6月23日だった。この一覧表では、最も後に登録された人の番号は「51」で、その5カ月前に登録されたKさんの番号は「42」。この2人の間に、「43」~「50」の計8人が登録されたことになっていた。これに対し、被告側が提出した症例登録一覧表には52人が掲載されていたが、その中にKさんは含まれていなかった。一方、双方が提出したKさんの登録票に記載された登録日は、「選択条件を満たしている」とする原告側提出の登録票も、「選択条件を満たしていない」とする被告側提出の登録票も、ともに1998年1月19日だった。
また、被告側は、実質的な症例登録業務は事務局が1998年3月に中外製薬から金沢大学医学部産婦人科に移転する半年以上前から大学に移行していたと主張し、その証拠として、1997年5月20日に金沢市立病院で登録された患者など3人の症例登録票を提出した。これらの登録票に記載された「登録先」は「金沢大学産婦人科」「金沢大学医学部附属病院産婦人科」などとなっていた。
これら文書の記載内容に基づき、原告側は、①被告側は、原告提出の症例登録票は「登録を決定するか否かを決定する過程で作成されたメモ的なものにすぎず、Kが登録された事実をしめすものではない」と主張しているが、その主張が真実とすれば、1998年1月19日にA医師によって登録を「可」とする登録票と「不可」とする登録票が作成されていることになるが、同じ日に登録「不可」の登録票が出ているわけだから、いくらなんでも、A医師が症例登録一覧表にKを「42」番として登録することは考えられない、②5カ月以上もKが症例登録一覧表に載せられていたことも常識では考えられず、被告提出の一覧表は、裁判のためにKのみを一覧表から消却し、52症例を記載したものであるとしか考えられない、③被告提出の金沢市立病院の症例登録票の登録日からすると、1997年5月ごろから実質的な登録業務は大学に移行していたことになるが、最終登録日が1998年6月23日となっている原告提出の一覧表が被告主張のように「中外製薬において作成」されることはないはずで、この矛盾も、被告提出の一覧表が裁判のために作成した内容虚偽の文書であることを示している――と指摘した。
このほか、Kさんがシスプラチンとシクロホスファミドの二つの抗がん剤を併用するCP療法を受ける前の腎機能を表す検査データの評価や、腎毒性があるシスプラチンの投与をめぐっても、原告と被告は対立した。
プロトコールによれば、腎機能をみる指標であるクレアチニンクリアランス(CCr、※筆者注=腎臓が1分間に濾過した血液の量を表す数値)が60ミリリットル未満、あるいは血中のクレアチニン(Cr)の値が1デシリットル当たり2・0ミリグラムを超える場合には選択条件を満たさないとされていた。Kさんは、CP療法を開始する4日前の1998年1月16日の検査でCCrが51・30ミリリットルと、北陸GOGの選択条件である「60ミリリットル以上」に達していなかった。
これについて原告側は2000年4月25日付準備書面で、①A医師はその陳述書で、北陸GOGのプロトコールで定められた使用量と使用法でCP療法を実施したことを認めているが、このプロトコールのシスプラチン投与量は標準的使用量を超える高用量であることは明らかである、②被告の主張するように、CP療法が一般診療として患者の治療を目的に実施されたのであれば、標準的使用量を著しく超える高用量の抗がん剤投与は、患者の生命を危険にさらすことにもなりかねず、到底ありえないことである、③まして、CP療法実施前の検査で腎機能障害があることが判明していたのであるから、このような高用量のCP療法を一般診療として行うことは到底ありえない、④にもかかわらず、プロトコールと同じ使用量及び使用法をもって、高用量のCP療法が行われたのは、Kが北陸GOGに症例登録され、比較臨床試験が実施されたからに他ならない――と主張した。
これに対し被告側は2000年7月17日準備書面で、①そもそもKを北陸GOGには登録していないのであるから、原告ら主張の投与基準は問題とはならない、②化学療法を行う場合の腎機能の評価は、血清クレアチニンの値とクレアチニンクリアランスの値の両者を総合的に勘案して行うのが、医学上の常識である、②Kの場合、化学療法開始時において血清クレアチニン値は正常範囲にあり、クレアチニンクリアランスの値も、北陸GOGで基準とされる値を多少下回っている程度のものであり、CP療法の投与量としては、医学的には全く問題のないところである、③Kのクレアチニンクリアランス値が北陸GOGの基準値を下回っていることからも、Kを北陸GOGに症例登録していないことが容易に推認される――と反論した。
前述したように、原告代理人の敦賀弁護士の要請を受けた打出医師は病院長に和解を打診したが、うまくいかなかった。この時点で打出医師が原告側に協力していることは大学側に伝わった。それと前後して、原告側は打出医師の証人尋問を裁判所に申請した。2000年9月27日付の「証拠申出書」によれば、尋問事項は、打出医師がKさんやその夫のSさんと知り合った経緯や、Kさんの治療についてどのような経過から疑問を持つに至ったか、などだった。しかし、実際に尋問が行われるのは2年近く後の2002年7月22日である。その間、原告被告双方は、Kさんの症例登録の有無以外の争点をめぐって対立することになる。
その一つが、「臨床試験とは何か」「北陸GOGのように、薬事法上の承認を得て公的医療保険の適用を受けている保険薬を用いた研究が、患者の同意取得が必要な臨床試験に当たるか否か」をめぐる攻防だった。
被告側は、「北陸GOGの比較研究が臨床試験に当たらないこと等を明らかにする」という立証趣旨で、金沢大学病院受託研究審査委員会(IRB)の小林健一委員長、同病院臨床試験管理センターの宮本謙一センター長連名の意見書(乙第30号証)のほか、東京慈恵会医科大学産科婦人科学の落合和徳教授の意見書と井上教授の陳述書を証拠として提出し、2001年2月8日付の準備書面で次のような主張を展開した。
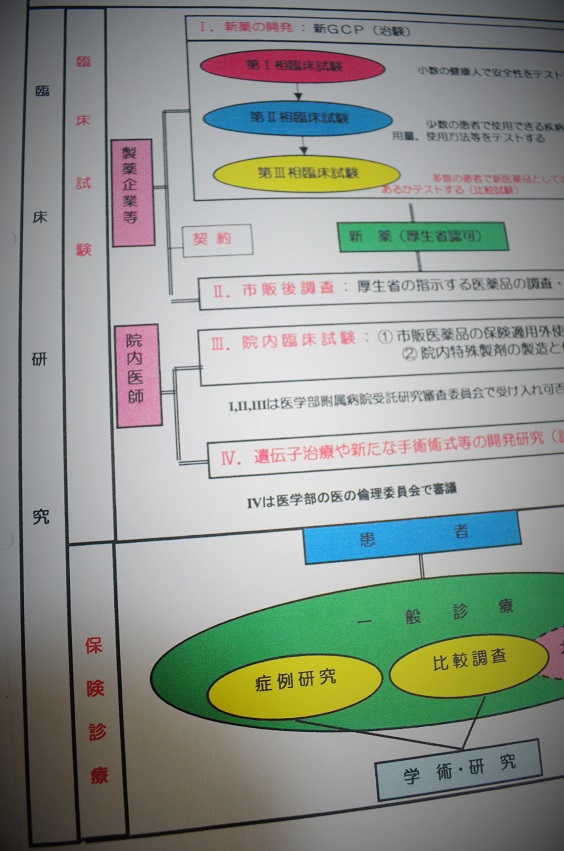 被告側が証拠として提出した、臨床研究の分類表。臨床研究を「臨床試験」と「保険診療」に分けている。
被告側が証拠として提出した、臨床研究の分類表。臨床研究を「臨床試験」と「保険診療」に分けている。前述した受託研究審査委員長と臨床試験管理センター長の意見書は北陸GOGの研究について、「保険適用内の治療法であるCP療法とCAP療法との比較調査であり、これら両療法は、国内外で広く採用されている治療法であり、かつ保険適用のある使用範囲内の治療であることから、IRBの審査の対象となる臨床試験には該当しません。すなわち、北陸GOGの比較研究は、異なった内容の保険診療を行った結果を比較検討するものであり、前記第1の4(医薬品の保険適用使用内での最適治療法の開発研究)に含まれることとなります。なお、保険適用内の治療を行うことにつき、文書による同意を必要としないことはいうまでもありません」と述べていた。
東京慈恵会医科大学の落合教授は日本産科婦人科学会と日本癌治療学会の評議員、婦人科がん化学療法共同研究会・卵巣がんプロトコール委員長などを務めていた。同教授は意見書で、欧米や日本国内の調査、研究でCP療法とCAP療法が卵巣がんに対して同等の効果を示すことがすでに明らかになっていることを理由に、1998年の時点で「奏功率を比較する臨床試験(無作為化比較試験)の対象とはならない」としたうえで、「金沢大学医学部附属病院産科・婦人科で採用されている用法・用量に関しても保険適応内の妥当な治療であって、例え事後、両療法の治療成績を集計し比較したとしても、何ら問題のない自主研究の範疇である」と述べた。
すでに紹介したように、被告側は北陸地域での卵巣がんの化学療法の標準化を図ることがこの比較研究の目的だった、と主張していた。この点について井上教授はその陳述書(2000年12月25日付)で次のように述べた。
医療の進歩は、日進月歩であり、標準的治療法も明日には古いものになりかねない時代であります。特に、大学医学部附属病院は、教育、研究及び診療を3つの柱にした高度先進医療機関であり、地域の医療施設に対して、適正な治療法を指導する重要な役割も果たしております。そのような大学医学部附属病院が、保険適応が認められている薬剤を、その薬剤の説明書の範囲内において、世界の文献で推奨されている用法に従って大学関連病院に対して指導し、また、その有効性を検証するのは当然のことであり、大学医学部附属病院の責務とさえいえます。
以上のことから、医師が日常の診療において、保険適応が認められている薬剤を、その薬剤の説明書の使用方法及び使用量において使用する行為は、完全なる裁量行為であるにもかかわらず、本件訴訟のように、その治療の結果が、患者の不幸ながんによる死亡という事態を受けて、損害賠償の対象になるとすれば、臨床医療は成立し得ないという極めて遺憾な、そして、深刻な問題となり、許容し難い結果となります。
「無作為比較試験」を行うことが明記されたプロトコールや
有料会員の方はログインページに進み、朝日新聞デジタルのIDとパスワードでログインしてください
一部の記事は有料会員以外の方もログインせずに全文を閲覧できます。
ご利用方法はアーカイブトップでご確認ください
朝日新聞デジタルの言論サイトRe:Ron(リロン)もご覧ください