警告する報告が相次ぐなか、このまま推進されるのか
2018年10月18日
筆者はこれまで「人間の生殖細胞系に対するゲノム編集」に議論の対象をしぼってきた。つまり受精卵などのゲノムを改変することによってその結果が未来世代にまで伝わるゲノム編集についてである。これは、英語圏では「遺伝しうるゲノム編集」と呼ばれることがある。
しかしながら最近、ゲノム編集技術の代表ともいえる「CRISPR/Cas9(クリスパー・キャス9)」自体に深刻な技術的限界があることを示唆する研究結果が相次ぎ、これが「遺伝しうるゲノム編集」にはもちろんのこと、「遺伝しないゲノム編集」にも影響する可能性があることが明らかになってきた。
以下、状況を整理しながら問題を指摘したい。
クリスパー・キャス9をはじめとするゲノム編集は、動物にも植物にも微生物にも適用できる。細胞の種類も問わない。本稿ではその対象をヒトにしぼる。ヒトに適用するゲノム編集を筆者なりに分類すると、表のように4種類に分けられる。
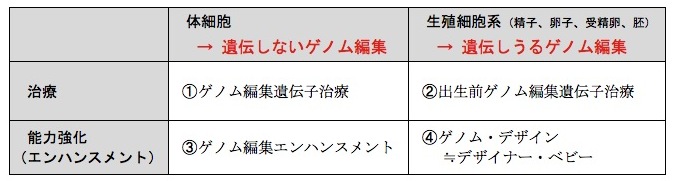 ヒトを対象にしたゲノム編集の類型
ヒトを対象にしたゲノム編集の類型今年6月11日、スウェーデンのカロリンスカ研究所の研究グループと、製薬大手のノバルティス社の研究グループが、クリスパー・キャス9によって編集された細胞が、がんを引き起こす可能性を示唆する実験結果を別々に報告した。論文はどちらも『ネイチャー・メディスン』の同じ号に掲載された。
カロリンスカ研究所のグループはヒトの網膜の細胞に、ノバルティス社のグループはヒトのES細胞(胚性幹細胞)とiPS細胞(人工多能性幹細胞)に、クリスパー・キャス9でゲノム編集を試みたところ、基本的に同じ現象が見られた。「がん抑制遺伝子」として有名な遺伝子「p53」が活性化することが観察されたのだ。p53がつくるタンパク質は、細胞の増殖を抑制したり、DNAの亀裂を修復したり、細胞が腫瘍化したときにはそれをアポトーシス(細胞死)に導いたりする機能がある。この遺伝子が働かなくなると、がんが発症すると考えられている。
p53が変異を起こして機能不全になることは、かなりの確率でがんにつながると考えられている。ある研究では、卵巣がんの約半数、結腸直腸がんの43%、肺がんの38%、膵臓がん、胃がん、肝臓がんの約3分の1、乳がんの約4分の1で、p53の変異が原因になっていると推測されている。非常に大きな割合だと言えるだろう。
カロリンスカ研究所の実験では、p53を持っていないか、もしくは活性化していない細胞で、ゲノム編集がうまくいくことが観察された。ノバルティス社が計算したところでは、p53が働いている場合、幹細胞ではクリスパー・キャス9の効率を17倍低下させる。これらの研究結果は、ゲノム編集が成功した細胞においてはそもそもp53が機能不全を起こしていた可能性が高いことを示唆する。ノバルティスの研究者らは、クリスパー・キャス9でゲノム編集をする効率を大幅に上げることに成功したのだが、それはp53が機能しなかったからだと推測される。p53の機能不全は、がんにつながりかねない。
ノバルティスの研究者らは論文で、ゲノム編集された細胞には「ゲノム操作の前にも後にも、機能を備えたp53遺伝子があることを確認することが重要である」と主張している。カロンリスカ研究所の研究者もまた、p53を抑制することがゲノム編集の効率を上げることを指摘し、「クリスパー・キャス9を活用して細胞ベースの治療法を開発する際には、p53が機能しているかを監視するべきである」と主張している。
 ゲノム編集のリスクを警告する報告が相次いでいる
ゲノム編集のリスクを警告する報告が相次いでいるDNAの削除は6000塩基にもおよぶことがあり、また、そうした削除は編集しようとした場所とは遠く離れたところで生じうることもわかった。研究者らは、クリスパー・キャス9を臨床に応用するさいには、このように生じる変異によって、「重大な病原性のある損傷」がもたらされる恐れがあると指摘する。そして一般的に使われている短いDNAを読み取る方法では検知できない変異もありうるので、患者への応用の前には「包括的なゲノム分析」が必要であると主張している。
有料会員の方はログインページに進み、デジタル版のIDとパスワードでログインしてください
一部の記事は有料会員以外の方もログインせずに全文を閲覧できます。
ご利用方法はアーカイブトップでご確認ください
朝日新聞社の言論サイトRe:Ron(リロン)もご覧ください