「患者を救え」と感情に訴え、冷静さを欠くメディア報道にどう向き合うか
2019年06月04日
白血病のための製剤キムリアが、厚生労働相の諮問機関である中央社会保険医療協議会(中医協)で承認された。従来の治療がきかなくなった患者への新たな治療法「CAR-T細胞療法」のための製剤だ。
 保険適用されることになったキムリア=ノバルティスファーマ社提供
保険適用されることになったキムリア=ノバルティスファーマ社提供日本の現行の保険制度では、この3349万円の薬価のうち、患者の負担は多くても数十万円程度だ。費用のほとんどは公的医療費から拠出される。こうした高額治療薬による医療財政の圧迫は社会問題としても認識され、日本の医療にも「費用対効果」の概念が導入されてきた。
さらに最近では、キムリアを遥かに超える価格のゾルゲンスマ(2億3000万円)もFDAで承認された。これは世界中で過去最高額だ。脊髄性筋萎縮症という遺伝性疾患に対する遺伝子療法で、2歳以下の小児への治療として認められる。脊髄性筋萎縮症は、生後6カ月ごろまでに筋肉の萎縮や呼吸困難を発症する希少疾患の重病で、患者の多くが乳児期に亡くなるか、人工呼吸器を生涯にわたって装着する必要がある。日本でも年内の承認が見込まれているが、こちらは乳児への処方なので全額が公的医療費で支払われる。「費用対効果」の議論は避けられないだろう。
しかしながら、この「費用対効果」とは「効果がプラスである」という大前提のもとに成り立つ議論である。ところがこの大前提が、日本の制度では揺らいでいる。この点が、厳格な審査によって承認されたキムリアやゾルゲンスマと、日本が世界の先陣を切って創設した「早期承認制度」による国産の再生医療等製品との決定的な違いである。
これら国産の再生医療等製品については、「スピード」を重視するあまりに、「厳格さ」が犠牲になっている恐れがある。ひとつ間違えると、無効で危険な製品が日本中にあふれかねない。患者にとってのみならず、50兆円に達するとされる国民医療費を納税で支えている国民にとっても深刻な問題である。
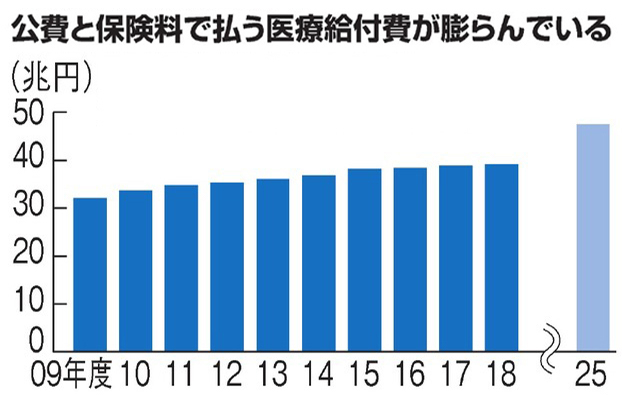 ※厚生労働省調べ。2017年、18年度は予算ベース、25年度は推計
※厚生労働省調べ。2017年、18年度は予算ベース、25年度は推計この懸念が集中的に表れているのが、7年間の条件付きで「早期承認」を受けた脊髄損傷治療の製剤「ステミラック注」だ。札幌医科大と医療機器大手ニプロが協同で開発した再生医療等製品で、医薬品医療機器総合機構(PMDA)で「早期承認」され、1500万円という高額薬価で保険適応が認められて市場に出たばかりである。
早期承認制度がその本来の目的を達成するには、2つの重要な段階が必須である。第1は、早期承認が有効性と安全性の両面において小規模でも信頼性が高い臨床試験に基づいていること、第2は、その後の市販後調査において従来の検証的臨床試験に匹敵するような厳格で公正な評価が担保されること、である。
だがステミラックについて、まず第1段階をクリアしていないことは、医療関係者であれば誰が見ても明白である。臨床試験はわずか13人の「治療群のみ」で評価されている。つまり、効果を比較検討するための「対照群」が存在しない。また、この臨床試験が学術論文として公刊されておらず、試験自体が学術的な審査をパスしていない。さらには、そもそも「静脈注射した細胞が損傷脊髄部に到達してその再生を促すという科学的な根拠」が希薄であることも挙げられる。
有料会員の方はログインページに進み、デジタル版のIDとパスワードでログインしてください
一部の記事は有料会員以外の方もログインせずに全文を閲覧できます。
ご利用方法はアーカイブトップでご確認ください
朝日新聞社の言論サイトRe:Ron(リロン)もご覧ください