新型コロナウイルスとの長期戦に備え、政治判断による攻撃戦略を
2020年05月09日
日本政府が新型コロナウイルス感染症(COVID-19)治療薬の第1号として、米国ギリアド・サイエンシズ社がエボラ出血熱の治療用に開発していた未承認の抗ウイルス薬「レムデシビル」を、日本の「特例承認制度」を用いて薬事承認した。特例承認制度とは「日本と同等の審査水準がある外国で承認されていることを条件に国内の審査を簡略化できる」という制度で、これによる承認は極めて異例である。レムデシビルについては、4月末にほとんど同時に、米国から2つのプレスリリース、中国から1つの学術論文が発表された。
 米国カリフォルニア州のGilead Sciences本社(shutterstock.com)
米国カリフォルニア州のGilead Sciences本社(shutterstock.com)これらの治験を俯瞰すると、劇的に効くといえる印象ではなく、腎障害や肝障害の副作用も多く報告されていることも気になる。むしろサイエンスを超えた米中間の政治的背景の関与を勘繰ってしまうが、日本政府はレムデシビルを特例承認した。ただし現在は治験に使う以外にレムデシビルの在庫はほとんどないとされている。政府は「日本も治験に貢献しているので一定の割り当て分があり、米国から調達できる」との見通しを示しているが、そうした貢献はごく少数例という話だし、臨床の現場に届くのは早くても夏になるという予測である。
こうした中で、日本発の治療薬にも新しい動きが出てきた。安倍総理は5月4日の記者会見で、抗インフルエンザ薬「アビガン(ファビピラビル)」について、月内に薬事承認が得られるよう厚労省に指示したことを公表した。タミフルなどの既存の抗インフルエンザ薬は、ウイルスを細胞内に閉じ込めることで感染細胞を増やさない働きをするのに対し、アビガンはウイルスの遺伝子複製そのものを阻害するため、既存薬に耐性を有するウイルスへの治療薬とみなされてきた。低分子化合物であるので量産が可能で、少なくとも国内供給が追い付かない心配は無さそうだ。
しかしながら、製造元の富山化学工業が承認を得た2014年の段階では、販売は開始されず、「他の薬剤が効かない新型インフルエンザと政府が判断した場合に、厚労省の要請を受けて製造を開始する」という特殊な承認となった。その適応症は「新型または再興型インフルエンザウイルス感染症。ただし、他の抗インフルエンザウイルス薬が無効または効果不十分なものに限る」とされ、市販後のデータなどは存在しない。その理由は、動物実験において初期胚の致死および催奇形性が確認されたためである。したがって、妊婦または妊娠している可能性のある女性には使えず、また精液中へ移行することから男性にも避妊が義務付けられている。
このアビガンについて、中国から論文が2つ(武漢大学と深圳第三人民病院)報告されている。どちらもプラセボ群のない他剤との比較試験であり、かつ、どちらの薬剤が使用されているか患者にも主治医にも分からないようにする二重盲検も行われていないため、治療効果ははっきりしなかった。
ところが最近、画期的な臨床研究結果が日本感染症学会のWeb特別シンポジウム(4月18日)で発表された。藤田医科大学微生物学講座・感染症科の土井洋平教授らによる迅速観察研究である。
治験対象は、COVID-19患者でアビガン治療をした346例(男性262、女性84)であり、高齢者中心で50歳以上が8割を超えている。主治医の判断によって「改善」「不変」「増悪」の3段階で評価した結果、投与開始14日後に軽症・中等症の約9割、重症患者でも約6割の患者で改善が認められた。重篤な有害事象は見られていない。
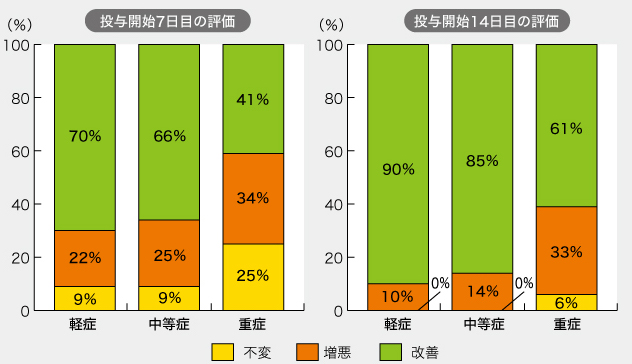 軽傷:酸素投与なし、中等症:酸素投与はあるが機械換気なし/または不明、重症:機械換気あり
軽傷:酸素投与なし、中等症:酸素投与はあるが機械換気なし/または不明、重症:機械換気ありこの臨床研究の問題点としては、①プラセボ群がない②評価が医師の主観によるものである③吸入ステロイドのシクレソニドなどとの併用療法も多い、などが挙げられるが、「軽症・中等症の約9割、重症患者でも約6割の患者で改善」という結果は、レムデシビルを含めて世界中で進められている500以上の治験の中でも目立っている。
現在、国内のCOVID-19患者に対するアビガンの供給は、医師法下での適応外使用(人道的使用)で、観察研究施設と認められた病院からの依頼に対して研究用サンプルとして配布されているに過ぎない。つまりアビガンを患者に投与するには医療機関が観察研究班に入る必要があり、煩雑な手続きと審査が求められる。未承認薬である以上、アビガンの使用には大きな障壁があり供給も不十分のままである。
アビガンはなぜ承認されていないのか、それは厚労省が「期限付き(条件付き)早期承認」を認めず、「通常承認」にこだわってきたからである。期限付き早期承認制度とは、患者数が少ないなどの理由で臨床第3相試験(フェーズ3)などの検証的臨床試験をすることが難しい医薬品について、発売後に有効性・安全性を評価することを条件に承認する制度で、対象となる医薬品は、次の4条件すべてに該当する品目とされている。
有料会員の方はログインページに進み、デジタル版のIDとパスワードでログインしてください
一部の記事は有料会員以外の方もログインせずに全文を閲覧できます。
ご利用方法はアーカイブトップでご確認ください
朝日新聞社の言論サイトRe:Ron(リロン)もご覧ください