降格や乏しい研究費を乗り越えてmRNAの活用法を見出した足跡を追う
2020年12月24日
 shutterstock.com
shutterstock.com2020年12月13日、日曜日の朝。
妻は早々にロッククライミングに出かけてしまい、残された私はベッドでiPadに流れてくるツイッターを眺めていた。すると、あるツイートが目にとまった。
カナダが新型コロナワクチンを全国民に無料で提供するという報道に対し、「すばらしい。好奇心からちょっと伺いたいのだけれど、どの国がワクチンを開発したの?」とツイートしたアメリカ共和党上院議員テッド・クルーズ氏への、テュレーン大学ウォルター・アイザックソン教授の回答である。
“Germany, by two Turkish immigrants.”
「ドイツ、二人のトルコ人移民によって」
日本の報道では大手製薬企業ファイザーの名前に隠れているが、人類史に残るであろう、この革命的mRNAワクチンの開発を推進してきたのは、ドイツの新興バイテク企業ビオンテック(BioNTech)だ。その設立者は幼少時にトルコからドイツに移り住んだ医科学者夫妻だったことに興味をもち、関連記事を調べていると、このワクチンは、研究者の世界の「ガラスの天井」に何度も跳ね返されてきた一人のハンガリー人女性研究者による画期的発見で可能になったことを知った。しかも、彼女の娘さんは、北京とロンドンの2回のオリンピックでボート競技の金メダリストだという。
 ケイト・カリコ博士(右)とビオンテック社創業者のオア・シャヒン博士=2013年7月、カリコ博士提供
ケイト・カリコ博士(右)とビオンテック社創業者のオア・シャヒン博士=2013年7月、カリコ博士提供幾度となく崖っぷちに立たされながらも、不屈の精神で新ワクチンにつながる発見をしたケイト・カリコ(Katalin Karikó)博士の大逆転ストーリーに感銘を受け、22の連続ツイートをしたところ、トップのツイートに1万6千もの「いいね」がつくという反響を得た。
今回は、思い切って直接カリコ博士にコンタクトを取り、zoom(パソコンを使ったテレビ会議システム)を通して伺うことができたお話も踏まえ、この革命的ワクチンの鍵となった発見にいたるドラマを紹介することにする。
新型コロナウイルスSARS-CoV-2がニューヨークで猛威を奮い始めた3月中旬、私はある報告書に戦慄を覚えた。インペリアルカレッジCOVID-19レスポンスチームによる被害予測だ。
何の感染抑制措置もとらなかった場合、英国では51万人、米国では220万人の死者が秋までに出るという。すさまじい数字だ。その後世界各地でロックダウンなどの抑制措置がとられたが、12月20日現在、英国では6万7千人、米国では31万人5千人の死者を出している。この報告書では、有効なワクチンが利用できるまでに少なくとも12-18カ月かかると予想していた。これでも異例の速さで、新しい病原体に対するワクチン開発にはこれまで10年以上かかっていたという。
しかし、12月に入って間もなく、米ファイザーと独ビオンテックが共同開発した新型コロナウイルスに対するmRNAワクチンの緊急使用が英国と米国で次々に許可された。1月11日に上海复旦大学の张永振(Zhang Yongzhen)教授の英断によって、新型コロナウイルスのゲノム配列が公開されてから、新型コロナウイルスのゲノム配列が公開されてわずか11カ月後のことである。
このmRNAワクチンが革命的なのは驚異的な開発スピードだけではない。95%という高い発症予防効果を示したことだ。ファイザー/ビオンテックの第三相治験結果によると、2回接種の後の有症状感染者数は、偽薬(プラシーボ)は2万2千人中162人だったのに対し、ワクチンは2万2千人中でたった8人だった。米モデルナ社のmRNAワクチンも同様の効果を示し、12月19日にアメリカで認可された。
 共同研究者の村松浩美博士=2014年、ドイツ・マインツのビオンテック社、カリコ博士提供
共同研究者の村松浩美博士=2014年、ドイツ・マインツのビオンテック社、カリコ博士提供この革命的ワクチン開発を可能とする重要な発見をしたのが、当時ペンシルベニア大学でたった一人の研究室を主宰していたケイト・カリコ博士であり、ケイトさんと15年以上にわたって共同研究されてきた村松浩美博士だ。2人は、実に19本もの論文で共著者になっている。
その一連の発見について語る前に、免疫系とワクチンが働く仕組みを簡単におさらいしておこう。
仮に、私が新型コロナウイルス(SARS-CoV-2)に初めて曝露したとしよう。体の中には様々な異物を認識する抗体を作り出す免疫細胞があるのだが、その時点で新型コロナウイルスを認識できる抗体を作る免疫細胞は少なく、抗体による防御には期待できない。病原体一般に反応する自然免疫系が対処できなければ、そのウイルスは私の細胞に入って増殖してしまう。これが感染だ。
感染と同時に、複雑な免疫システムが発動する。樹状細胞と呼ばれる免疫細胞は、ウイルスを積極的に取り込んで分解する。分解されたウイルスたんぱく質の一部は細胞表面に運ばれて、「こういう特徴のウイルスに感染されました!」との「標識(抗原)」を周囲のリンパ球に提示する。数百億種類はあるとされるリンパ球のうち、この抗原を認識するリンパ球が選ばれ活性化する。このうちB細胞と呼ばれる抗体産生細胞が増殖し、抗体の設計図(遺伝子)はさらに書き換えられ、より強力な抗体を作ることができるB細胞が体内に備蓄される。
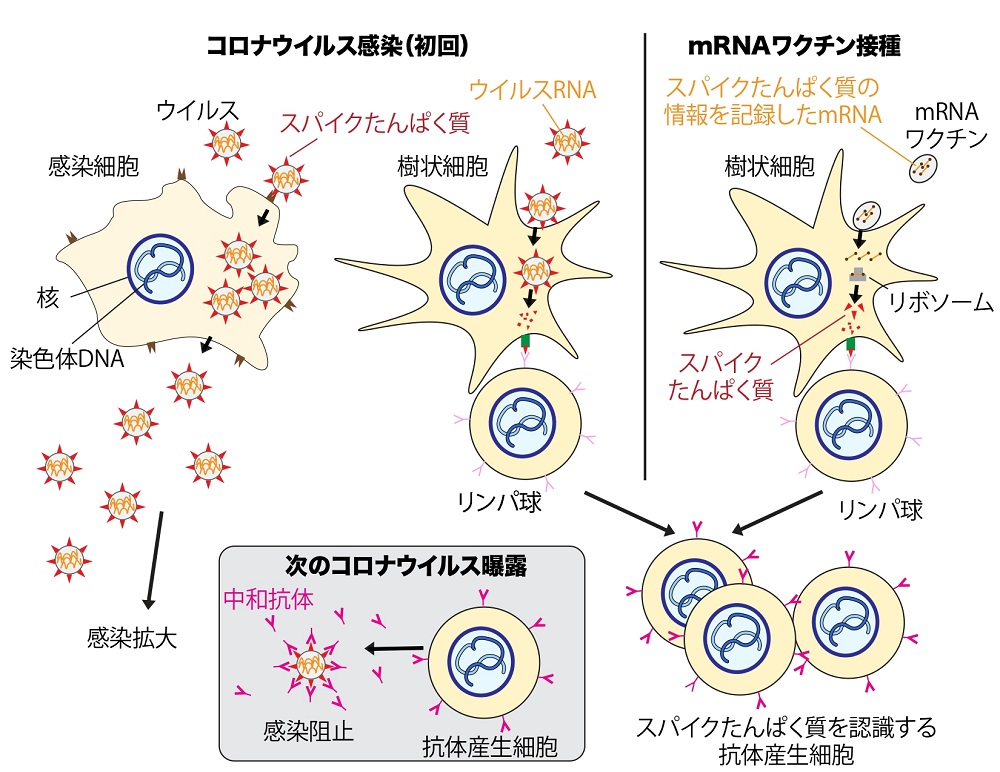 コロナウイルスに一度感染する、もしくはワクチンを受けると、抗体産生細胞が増え、次にウイルスがやってきたときに感染を阻止できることを示す模式図
コロナウイルスに一度感染する、もしくはワクチンを受けると、抗体産生細胞が増え、次にウイルスがやってきたときに感染を阻止できることを示す模式図私が新型コロナウイルスに再び曝露したならば、この強化型バージョンの抗体(中和抗体)が直ちに反応し、ウイルス感染を防ぐことが期待できる。ワクチンでは、ウイルスの部分的なパーツだけを抗原として利用することで、それを接種しても発症することなく、将来ウイルス防御に役立つ中和抗体を効果的に作れるようにするのを目的としている。
新型コロナウイルスの場合、従来型のコロナウイルスなどの研究により、ウイルス表面に突き出したスパイクたんぱく質に反応する抗体が、中和抗体として感染防御に役立つと予想されていた。ウイルス感染にはスパイクたんぱく質がヒトの細胞表面に結合することが必要なので、スパイクたんぱく質に抗体が結合して細胞内部への進入をブロックできれば感染を防ぐことができるはずだ。
旧来のワクチンは、弱毒化した生ワクチン(生きているウイルスを使う)や、不活化ワクチン(ウイルスを壊して使う)が主流だった。しかし、全く新しいウイルスに対しては、効果的に弱毒化や不活化する手法を試行錯誤する必要があるだけでなく、ウイルスの培養作業に万全の感染対策を施すことが求められる。だが、もしスパイクたんぱく質だけを人工的に作りだしてワクチンに利用できれば、開発・製造過程で感染を心配する必要はない。つまり開発コスト、時間の大幅な削減が可能だ。
ところが、遺伝子工学が進歩した今でも、収率良く目的のたんぱく質を大量生産するのは簡単ではない。DNAやRNAはA、G、C、T(RNAの場合はTの代わりにU)の4種類の核酸が様々な順番で並んだ鎖状構造体だが、たんぱく質は20種類のアミノ酸が連なった構造をとるため、その性質や機能は多様で、周囲の環境によって安定性が大きく変化する。大量生産できるかどうかは、実際に実験してみるまで分からないことがほとんどだ。実際、スパイクたんぱく質を大量に作るのは簡単ではなかった。
そこで、スパイクたんぱく質だけを人間の体の中で作らせてしまうという大胆な作戦をとっているのが、英アストラゼネカとオクスフォード大などが開発しているウイルスベクター系ワクチン、大阪アンジェスなどのDNAワクチン、そしてファイザー/ビオンテックやモデルナなどのmRNAワクチンだ。
有料会員の方はログインページに進み、デジタル版のIDとパスワードでログインしてください
一部の記事は有料会員以外の方もログインせずに全文を閲覧できます。
ご利用方法はアーカイブトップでご確認ください
朝日新聞社の言論サイトRe:Ron(リロン)もご覧ください