「自分に何ができるのかだけを考え、それにエネルギーを注ぐのです」
2020年12月25日
前回は、ワクチンが働く仕組みと、その開発の難しさを中心に解説した。今回は、新型コロナワクチンがなぜこれほど超短期間で開発できたのか、その「奇跡」に欠かせなかった数々のブレークスルーを起こしたカリコ博士の物語を紹介する。
 ケイト・カリコ博士=Béla Francia撮影
ケイト・カリコ博士=Béla Francia撮影当時は、DNA合成装置や自動PCRマシーンが世界中の研究室に導入され始め、遺伝子治療への期待が広がり始めたところだった。特定の遺伝子機能が欠損した患者の細胞に、正常な遺伝子をもつDNAを導入すれば病気を治すことができるのではないか? しかし、カリコ博士はその手法に問題点を感じていた。カリコ博士は言う。「DNAは長期間生体内に残ってしまいます。治療が終わった後、必要がなくなれば除去できるほうが望ましいでしょう。mRNAは短期間で分解されるので、mRNAを導入して一時的に必要なたんぱく質を作らせるのがより良い方法だと思ったのです」
1990年には、このアイデアをもとにした研究費申請書をNIH(国立保健研究所)に申請したが、承認されることはなかった。
1997年、偶然の出会いがカリコ博士の研究をmRNAワクチン開発へと導くこととなった。脳神経外科のスタートアップファンドを得て、たった一人の研究室を立ち上げたカリコ博士が廊下でコピー機を使っていると、隣の建物からそのコピー機を使いに来た新顔の男性と立ち話することになった。彼はドリュー・ワイスマン(Drew Weissman)と名乗り、(今年アメリカの新型コロナウイルス対策の「顔」として一躍有名になった)アンソニー・ファウチ博士の下でエイズウイルス(HIV)の研究をしたあと、ペンシルベニア大学に着任したばかりだという。HIVワクチン開発に意欲を持っていたワイスマン教授が「DNAワクチンではどうもうまく行かないのですよね」と話すので、「RNAでやってみませんか?」と返答した。こうして2人はたちまち意気投合し、mRNAワクチン開発の共同研究が始まった。
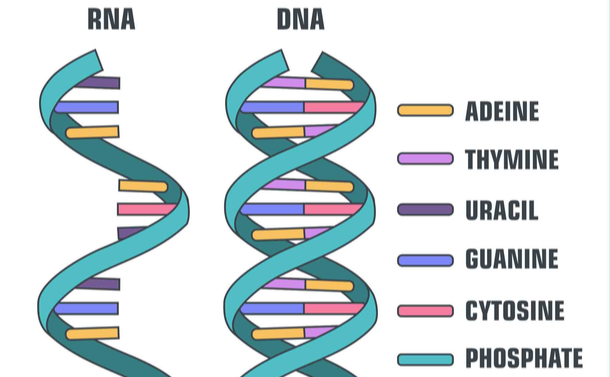 RNAとDNA。青いリボン状が「リン酸」で、右側の説明の一番下にある。それ以外の説明は「塩基」で、上からアデニン、チミン、ウラシル、グアニン、シトシン=shutterstock.com
RNAとDNA。青いリボン状が「リン酸」で、右側の説明の一番下にある。それ以外の説明は「塩基」で、上からアデニン、チミン、ウラシル、グアニン、シトシン=shutterstock.comしかし、外部から導入された「異物としてのmRNA」は不安定ですぐ壊れてしまい、目的のたんぱく質は思ったように合成できなかった。さらに、異物を認識する自然免疫系に捉えられ、炎症反応が誘導されてしまう(ワクチンによる抗体産生誘導にはアジュバント効果という炎症反応を起こすことも重要なのであるが、適正にコントロールしなければワクチンとしてもうまくいかないらしい)。
不思議なことに、細胞内に元々ある自分自身のmRNAはたんぱく質合成をするのに十分に安定であるし、炎症反応も引き起こさない。何故か? ここでカリコ博士は、細胞内のRNAは様々な化学修飾を受けていることに注目した。教授職ではなかったことが影響して研究費を獲得できなかったカリコ博士だったが、ワイスマン教授が共同研究用に獲得した研究費を使って、2005年、人工的に作ったmRNAに化学修飾を施しておくと、mRNAを細胞内に導入しても炎症反応が低く抑えられることを発見した。
その頃からカリコ博士、ワイスマン教授のチームに、隣の研究室に所属していた動物実験のエキスパート・村松浩美博士が加わった。村松博士はフランク・ウェルシュ(Frank Welsh)教授の下で脳虚血が起こす炎症反応の研究をしていたが、研究の行き詰まりを感じていた。熱意あふれるカリコ博士からの誘いを受けると、ウェルシュ教授が黙認する形で共同研究が始まった。
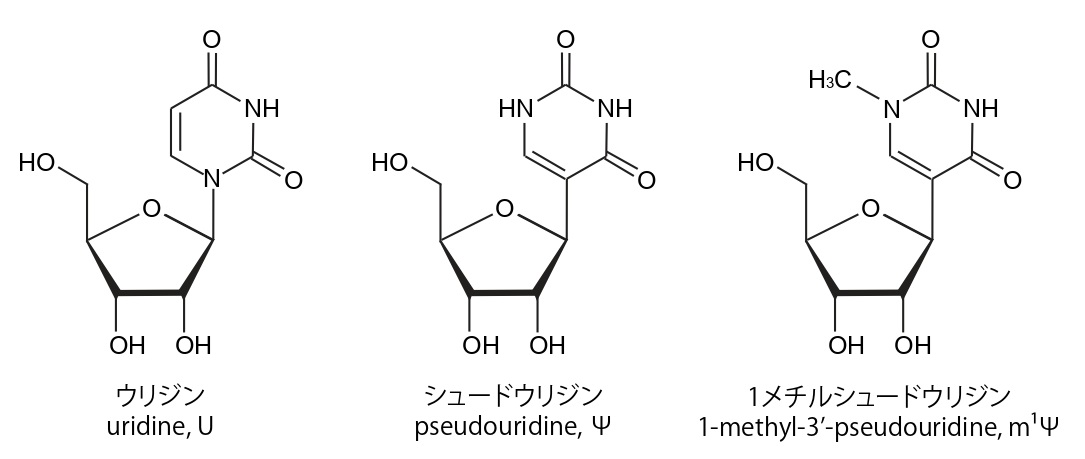 RNAを構成する塩基「ウリジン」と、それを化学修飾した「シュードウリジン」。ウリジンをシュードウリジンに置換したmRNAワクチンを使うと、炎症反応が抑えられるだけでなく、目的のたんぱく質が大幅に増える。ファイザー・ビオンテックのワクチンでは「1メチルシュードウリジン」が使われている。
RNAを構成する塩基「ウリジン」と、それを化学修飾した「シュードウリジン」。ウリジンをシュードウリジンに置換したmRNAワクチンを使うと、炎症反応が抑えられるだけでなく、目的のたんぱく質が大幅に増える。ファイザー・ビオンテックのワクチンでは「1メチルシュードウリジン」が使われている。カリコ博士はワイスマン教授とスタートアップ会社RNARxを2006年に設立し、NIHの中小企業技術移転プログラムを通じて研究費を獲得し研究を続けた。そして、2008年、カリコ博士・村松博士・ワイスマン教授のチームは、典型的なRNA塩基ウリジン(U, uridine)の代わりに、化学修飾を施したシュードウリジン(Ψ, pseudouridine)を導入したmRNAを用いると、たんぱく質の生産効率が劇的に向上することを発見した。この画期的な技術が、現在のmRNAワクチンに使われることとなった。
2012年には、修飾mRNAをマウスに注射するだけで、効果的に目的たんぱく質を生体内で作らせることを示す決定的な結果を発表した。さらに2013年、ワイスマン研究室のノーベルト・パーディ(Norbert Pardi)博士と共同研究で、脂質ナノ粒子(lipid nanoparticle, LNP)でmRNAを包んでマウスに注入すると、ごく少量のmRNAで効果的なたんぱく質合成が可能となることが分かり、ここにいたってmRNA導入による治療法が技術的に実現可能なことを確信した。
ところが、
有料会員の方はログインページに進み、朝日新聞デジタルのIDとパスワードでログインしてください
一部の記事は有料会員以外の方もログインせずに全文を閲覧できます。
ご利用方法はアーカイブトップでご確認ください
朝日新聞デジタルの言論サイトRe:Ron(リロン)もご覧ください