出島に集まる好学者⑤ 更なる高みを目指した海外研究者との連携
2023年04月20日
「ナノ医療イノベーションセンター」(iCONM)は、ナノ医療に特化した公的研究機関で、国内はもとより世界中からトップレベルの研究者が集まっている。日夜取り組んでいる研究の一つが、薬剤を体内の狙った場所(多くの場合、患部)に届けるDDS(Drug Delivery System:薬剤送達システム)だ。
薬剤は投与された後、血流に乗って全身に分散し、何時間か経た後に尿中や胆汁中に排出される。もし、狙った組織だけに薬剤を送達する(届ける)ことができれば、投与量を減らすことができるばかりか、正常な組織を薬剤に暴露させるリスクも少なくできる。
さらには脳や筋肉、がん組織などは、薬剤が浸透し難い組織であることが、しばしば治療の妨げとなる。このため、こうした組織に薬剤を浸透させる技術の研究開発は、医療の進歩に大変重要である。
iCONMでは、ポリエチレングリコール(PEG)とポリアミノ酸(PA)からなる鎖状の高分子化合物に薬剤を連結させたものを水中で自然に凝集(自己会合)した「高分子ナノミセル」(スマートナノマシン®:以下ナノマシン)を基本構造に、用途に応じて様々なDDS機能を持たせることに成功している。
一般に、ナノミセルを用いたDDSを「ナノDDS」、その結果として実践できる医療技術は「ナノ医療:nanomedicine」と呼ばれる。本稿では、iCONM が目指す難治がん治療の取り組み「ナノDDS」について紹介する。
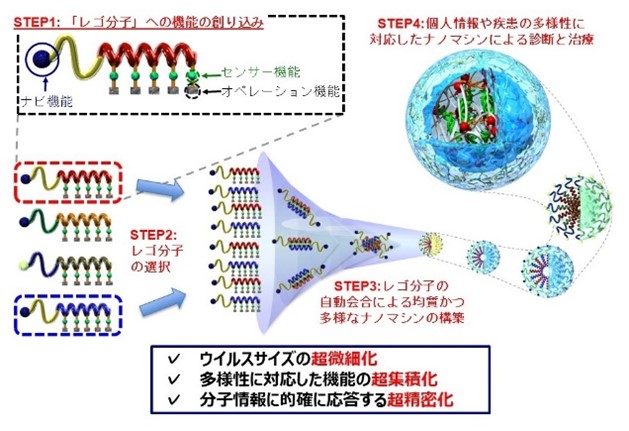 図1:自己会合による薬剤搭載ナノマシンの構築=iCONM提供(以下★)
図1:自己会合による薬剤搭載ナノマシンの構築=iCONM提供(以下★)2022年11月に国立がん研究センターが発表した統計によると、日本人ががんで死亡する確率(2021年のデータに基づく)は、男性で26.2%(4人に1人)、女性で17.7%(6人に1人)とのこと。かつては、3人に1人ががんで亡くなると言われていた時から比べると、がん治療も大きく進歩しているのだといえる。
しかしながら、いまだ治療の難しい「難治がん」というものもあり、その代表格として膵臓(すいぞう)がんがあげられる。他にも、臓器別5年生存率だけを見ると比較的予後が良いとされる乳がんや胃がんでも、ホルモン剤やある種の抗がん剤が効きにくいトリプルネガティブ乳がんやスキルス胃がんのように予後が悪いものや、グリオブラストーマ(GBM:神経膠腫=しんけいこうしゅ)という進行が早く再発率も高い脳腫瘍(しゅよう)もある。
難治がんであっても、早期に発見し、外科手術で取り除くことができれば予後もそう悪くないこともあるが、早期発見が難しく、初診時に進行がんとして診断されることが少なくない。また、進行がんであっても副作用を制御しながら、がん組織を小さくし、あるいは消失させることができる抗がん剤が効きにくい。
近年の研究によれば、難治がんの特質として「間質」と呼ばれる線維組織が発達し、それがバリアーとなって薬剤や免疫細胞ががん組織に流入することを阻害しているようだ。特定の遺伝子発現(遺伝情報に基づいてたんぱく質が産生されること)の異常が、正常な細胞ががん化する原因となることも分かってきた。
例えば、難治がんでは、後述するPRDM14というたんぱく質が多く発現していることが知られている。このたんぱく質は、細胞の増殖を促し、胎児の成長にかかわるとされるが、出生後は発現しなくなる。PRDM14を発現している細胞は免疫細胞の攻撃から守られる性質があり、これが何かの原因で活動を再開すると、難治がんを生み出すという。
がんは、正常な細胞が物理的、化学的要因によって遺伝子が傷ついて、がんが発生することが知られている。実は、このような遺伝子損傷は毎日のように起きていて、その都度、傷ついた遺伝子を修復し、修復が困難な場合にはがん化する前に自らその細胞を死滅させる防御機能を生体は持っている。防御機能が何らかの原因で働かなくなると細胞のがん化が起き、がん細胞が誕生する。この段階であっても、通常は免疫機能が働き、誕生したがん細胞は速やかに駆逐されるが、それも機能しないとがん細胞は増殖し、「悪性腫瘍」として検知される。
このようにがん細胞も人の細胞であることは変わりなく、がん細胞に作用する薬剤は正常細胞にも作用してしまうため、他の疾病の治療薬と比べて副作用の度合いが強くなってしまう。それゆえ、DDS技術を用いた理想的な抗がん剤は以下の要件を満たすものとなる。
① 投与後、正常細胞には届かず、がん細胞だけに届く
② がん組織の中でだけ活性化されて効果がでる
③ 難治がんでバリアーとして機能する線維組織を突破できる
①に関しては、分子サイズが大きくなると正常組織に比べてがん組織に集まりやすくなるEPR効果という現象が知られている。ナノマシンのサイズは 30-50nm で、正常組織にある血管のすき間からは漏出できない。それに対して、がん組織にある血管には、100nm程度の隙間があるため、ナノマシンは血管から漏出してがん細胞に作用することができる。
 図2:EPR効果=★
図2:EPR効果=★②に関しては、ワールブルグ効果と呼ばれるがん組織が正常部位に比べて酸性に寄っているという現象を利用する。これは、がん細胞が酸素不足の状態でも生きられるように嫌気的呼吸を行っており、副産物として乳酸を産生することが酸性となる要因である。また、この呼吸法には大量のブドウ糖摂取が必要で、PET検査はこの特性を利用したものである。
③に関しては、uPICと呼ばれる世界最小のナノマシンが開発されており、トリプルネガティブ乳がんにおけるPRDM14の発現を抑制する核酸医薬を搭載したナノマシンが第I相臨床試験として既に使用されている。
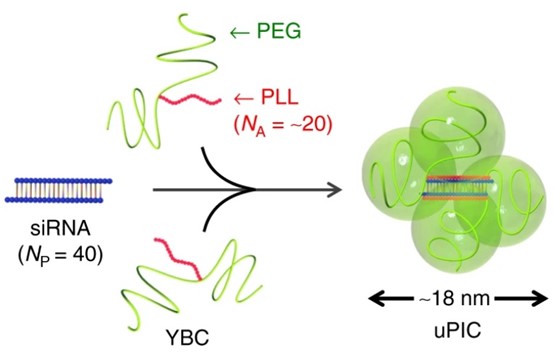 図3:uPIC (Unit Polyion Complex)マイナスの電荷をもつRNA鎖に対して、プラスの電荷をもつポリリシン(PLL)が静電的に2分子会合してできる複合体。PEGがY字形に2分子結合したものが安定な構造となる。K.Miyata et al.,Nature Communications,10,1894(2019)=★
図3:uPIC (Unit Polyion Complex)マイナスの電荷をもつRNA鎖に対して、プラスの電荷をもつポリリシン(PLL)が静電的に2分子会合してできる複合体。PEGがY字形に2分子結合したものが安定な構造となる。K.Miyata et al.,Nature Communications,10,1894(2019)=★質の悪い脳腫瘍として知られるGBMの中でも、がん抑制遺伝子のひとつであるPTEN遺伝子に異常がある場合は十分な治療法が確立していない。その理由として、GBMはがん細胞を攻撃するTリンパ球ががん細胞の中に侵入することを阻止するバリアーが発達し、免疫反応が抑制されている傾向にあることが挙げられる。
そこで、iCONMの喜納宏昭・主幹研究員らのチームは、細胞にアポトーシス(自死)を起こさせ、免疫反応を呼び戻す力がある「エピルビシン」という古くからある抗がん剤に着目した。
エピルビシンには副作用として強い骨髄抑制(赤血球や白血球、血小板といった血液細胞の産生に異常を来す)があることが知られている。その副作用を緩和する目的で、ナノマシンに搭載したものをGBMマウスモデルに投与し、効果を調べた。また、エピルビシンの効能でTリンパ球のがん細胞の中へ侵入が可能となったことで、免疫チェックポイント阻害剤 (ICI)との併用を検討した。さらに、免疫誘導細胞死 (免疫細胞を誘導する旗が、死んだがん細胞に立つタイプの細胞死)を引き起こすエピルビシンをがん組織に選択的に届けるとともに、ICIを併用することで、相乗効果に期待した。
その結果、GBMを脳に移植したマウスでもよく効き、生存期間は有意に延長した。安全性の点でも、ナノマシンに搭載することで副作用の骨髄抑制は、有意に減少した。注1
PRDM14は、2007年に乳がん組織でよく発現する転写因子(遺伝情報に基づいたたんぱく質合成を調節する物質)として世界ではじめて日本の研究者が報告した。その後、2017年にiCONMの谷口博昭・客員研究員(慶応大学医学部)らは、PRDM14分子が膵臓がん等の難治がんで多く観察され、抗がん剤や免疫に対する抵抗性や転移・浸潤、血管新生をがん細胞に促すことを見いだした。東京大学では、極めて安全性・血中安定性が高く、制御したい遺伝子のmRNAに作用して、その働きを止めてしまうよう設計された短い人工RNA鎖「siRNA」が開発された。
こうして、PRDM14分子に対するsiRNAを、iCONMで開発した最小サイズのナノマシン(uPIC)に搭載した製剤「 PRDM14siRNA核酸医薬候補」で、トリプルネガティブ乳がんおよび膵臓がんの動物モデルでの有効性を調べた。治癒的切除できないがんに対応するため静脈注射で投与した結果、トリプルネガティブ乳がん移植モデル、膵がん皮下移植モデルの双方において、がん組織の径の増大を抑制し、抗がん剤との併用で相乗的な治療効果を示すことがわかった。
さらに、遠隔転移モデルでも、転移巣が減少し、生存期間の延長が認められた。また、安全性試験 (非臨床試験)で重篤な有害事象は認められなかったため、治癒的切除不能又は遠隔転移を有するトリプルネガティブ乳がんの再発患者を対象とした臨床試験 (第Ⅰ相)を実施している。注2
園芸植物としてお馴染みのニチニチソウは、細胞分裂を抑制するビンブラスチンという化合物を根に含んでいて、その強い細胞毒性から様々ながんの治療に用いられる。しかし、副作用も大変強いため、臨床での使用は容易でない。それゆえ、ナノマシンへ搭載してがん組織のみに送り届けようとする試みがiCONMでも検討されてきた。
筆者のチームは、ナノマシンに搭載する上でより好ましい化学構造を持ち、胞増殖抑制効果が6倍強いタイプのビンブラスチン (DAVBNH) を抗がん剤として選択し、ナノマシンを構成する部品との連結方法について研究を重ねた。がん細胞の内部は、正常細胞と異なり酸性であるため、酸性でのみ切断される連結分子(リンカー)を発見し、その節電に適した酸性度が異なる2種類のリンカーを創成した。
また、悪性腫瘍はがん細胞の塊であり、表面から内部に向かうに従って酸性度が高くなる。がん組織に届いたナノマシンががん組織の表面だけで抗がん剤を放出してしまうと、中心部にはほとんど効果がない。筆者らが開発した酸性度が違うリンカーを使い分けることで、表面で作用するナノマシンと、内部で作用するナノマシンを使い分けることが可能となり、より効果的な抗がん作用をGBMモデルで実証した。注3
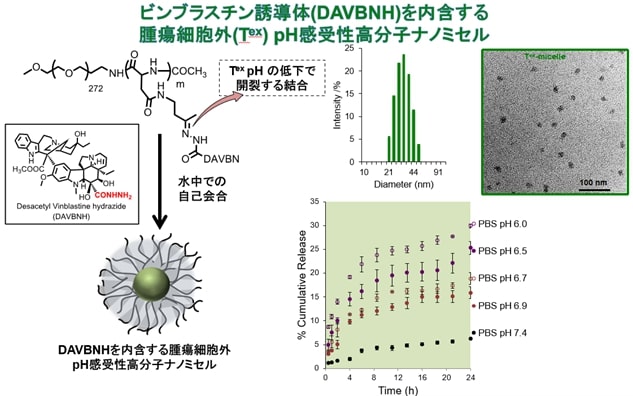 図4:酸性が強くなると開裂するリンカーを利用したナノマシンの構築=★
図4:酸性が強くなると開裂するリンカーを利用したナノマシンの構築=★前述したように、トリプルネガティブ乳がんや膵臓がんといった難治がんは、間質と呼ばれる線維組織が発達し、まるでエネルギーシールドで覆われたエイリアンの宇宙船のように、免疫細胞や抗がん剤といった外部からの攻撃に対して抵抗性を示す。
iCONMのオラシオ・カブラル客員研究員(東京大学大学院工学研究科)らのグループは、キプロス大学との共同研究で難治がん特有の異常に発達した線維組織を正常化(弱体化)させるナノマシンの開発に成功した。同種の研究はこれまでも行われているが、治療量(有効性を示し、中毒に至らない投与量)の幅がとても小さく、安全性の問題が常につきまとっていた。
本研究では、トラニラストという薬剤に着目し、それをナノマシンに搭載してがん細胞の内部まで届けた。その結果、ナノマシンを使わずにトラニラストを投与した場合(遊離型)と比べ、1/100の量でトリプルネガティブ乳がんモデルマウスの線維組織を正常化できる。つまり、より安全に難治がんのシールドを弱体化できることが可能となった。
続いて実施した、エピルビシン搭載ナノマシンおよび免疫チェックポイント阻害剤の投与の結果、トリプルネガティブ乳がんマウスでがん組織の消失を達成した。さらに、がん組織が消失したマウスに、新しくトリプルネガティブ乳がん細胞を移植しても定着しなかったことから、がん免疫を獲得することも確認でき、このことは再発の防止にもつながると考えられる。注4
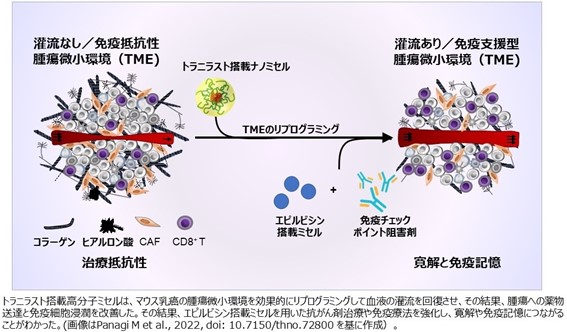 図5:トラニラスト搭載ナノマシンを用いた難治がんシールドの弱体化(リプログラミングとは機能分化により調節された遺伝子発現を基に戻すことをいう)=★
図5:トラニラスト搭載ナノマシンを用いた難治がんシールドの弱体化(リプログラミングとは機能分化により調節された遺伝子発現を基に戻すことをいう)=★
難治がんのなかで、身体の防御反応として作用する免疫が働きにくいタイプを Cold Cancer(冷たいがん)と呼ぶ。これは、免疫反応が患部で炎症を引き起こし発熱させることに由来するものだが、免疫抵抗性の難治がんでは前述のとおり、異常に発達した線維組織がバリアーとなって免疫細胞が患部に近づくことができず発熱が起きない。
免疫細胞が患部で産生する炎症起因物質の中でも最も強力なものがILー12(インターロイキン12)と呼ばれるたんぱく質で、特にがん免疫に関わるNK(ナチュラルキラー)細胞を活性化しがん細胞への激しい攻撃で相手を撃破する。そのため、昔からがんの免疫療法の筆頭格にありながら、その激しい副作用により臨床での使用は極めて限定的である。
オラシオ・カブラル客員研究員(東京大大学院工学系研究科)らのチームは
有料会員の方はログインページに進み、デジタル版のIDとパスワードでログインしてください
一部の記事は有料会員以外の方もログインせずに全文を閲覧できます。
ご利用方法はアーカイブトップでご確認ください
朝日新聞社の言論サイトRe:Ron(リロン)もご覧ください