朝日ニュースター
2011年04月29日
==============================================
朝日グループのジャーナリズムTV「朝日ニュースター」は、通信衛星などを利用して24時間放送しているテレビチャンネルで、ケーブルテレビ局やスカパー!などを通じて有料視聴することができます。4月から始まった新番組「科学朝日」は、高橋真理子・朝日新聞編集委員がレギュラー出演する科学トーク番組です。WEBRONZAでは、番組内容をスペシャル記事としてテキスト化してお届けします。
====================================================================
高橋:こんばんは。科学の最先端にひたる『科学朝日』。朝日新聞のWEB言論空間、「WEBRONZA(ウェブロンザ)」と連動してお送りします。
今回のテーマは、「インターロイキン(IL)-6の発見と免疫疾患」です。インターロイキン6という言葉、聞いたことがないという方も多いのではないかと思います。これは、私たちの体の中でさまざまな働きをしている重要な物質です。一方で、これが多すぎるといろいろな病気を引き起こします。たとえば「関節リウマチ」です。

今、インターロイキン6の働きをブロックして、関節リウマチの進行を食い止める薬が患者さんに使われ始めています。本日は、このインターロイキン6を発見し、その多様な機能と複雑な情報伝達回路を解明しました、大阪大学教授の岸本忠三(きしもと・ただみつ)さんにお越しいただきました。岸本先生、よろしくお願い致します。
岸本:よろしくお願い致します。
高橋:まずは、このたびの日本国際賞のご受賞、おめでとうございます。
岸本:どうもありがとうございます。我々の40有余年にわたる私のライフワーク、IL-6の研究が認められて、こういう賞を頂けたということを大変うれしく思っております。
高橋:IL-6がインターロイキン6ですね?
岸本:ええ。
高橋:長年一緒に研究されてきた平野俊夫大阪大学教授と共同のご受賞ということになりました。
岸本:はい。その40年ほどのあいだには、数え切れないほど多くの共同研究者と共同研究をしてきましたけれども、その代表としての平野俊夫博士と一緒に頂けたということは大変うれしく思います。
発表の記者会見のときにも言ったんですけれども、医学の研究というのは、なんの役に立つかというふうなことを考えなくても、神髄をついた研究は必ずヒトの病気の診断や治療に役立つものであると。そういうことのひとつの例として、この研究が認められたということが大変うれしく思っています。
高橋:そうなんですね。日本国際賞は、患者さんを救う業績を上げられたということを大変高く評価した。
岸本:ああそう。先ほど言われたように、関節リウマチをはじめとして、免疫難病の治療につながってきたということが評価されたんだと思ってるんです。
高橋:そうですね。で、この4月に授章式が予定されていたんですが、これは中止になりましたね。
岸本:それはまあ、今回のこのような大震災を思うと、それは当然のことだと思いますけれども、1日も早い復興ということを願って、我々も賞金の一部はそういう義援金として寄付させていただきたいというふうに考えています。
高橋:これだけの大きな災害ですと中止もやむを得ないと思いますけれども、ただ一方で、被災地の外にいる私たちは、なるべく普段の生活をして活力を下げないようにすることも大事なことだと思います。今日は詳しく、その受賞対象となったご研究について、うかがっていきたいと思います。それでは、改めて本日のゲスト、大阪大学教授の岸本忠三さん、よろしくお願い致します。
岸本:お願い致します。
高橋:それでは、インターロイキン6、IL-6についてお伺いしていきたいと思います。
先生は、この分子の存在を70年代の初めに発見されて、1986年に遺伝子の配列を世界で初めて、いちばん最初に解明されたということなんですが、なぜこの物質に興味をもたれたんでしょうか。
岸本:インフルエンザなどの感染症から体を守る免疫の働きというのは、血液の中を流れている白血球によって仲介されているわけですね。その白血球の中にもいろいろな種類の細胞があるわけです。
白血球というものは英語で「ロイコサイト(leukocyte)」といいますから、そのロイコサイトのあいだをつなぐ、情報を伝達し合う分子という意味で、「インターロイキン(interleukin)」という名前がついているわけなんですけれども、それで免疫のいちばん中心的役割を果たすのは、最初のここ。
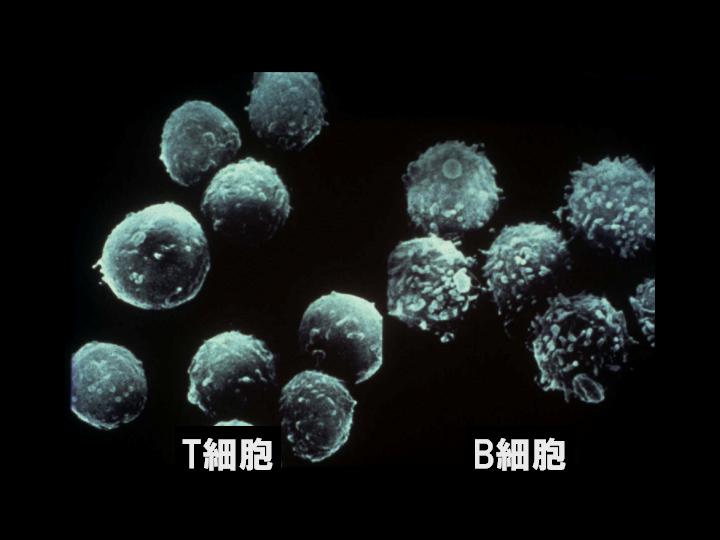
高橋:はい。白血球ですね。
岸本:Tリンパ球とBリンパ球という、2つのリンパ球がいちばん主役をなしているわけですね。
高橋:どっちも白血球なんですね?
岸本:白血球のなかの、いわゆる2つですね。
で、抗体を作って、たとえば、インフルエンザのウイルスをやっつけるとかいう働きをするのは、Bリンパ球なんです。だけど、Bリンパ球だけでは抗体を作れなくて、Tリンパ球の存在が必要なんです。それは1968年の発見なんですけれども、そうすると、Tリンパ球は何か、Bリンパ球に抗体を作れと指令している分子が出ているに違いないというふうに、我々は、僕は考えたわけです。
高橋:はい。
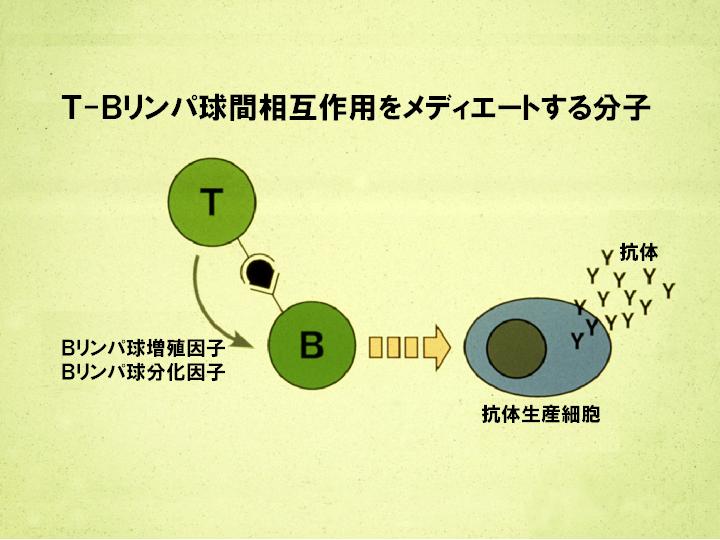
岸本:抗体作るということは生命にとって必須のことです。抗体がなければ、人間は1日として生きていくことはできないと。そういう抗体を作らせる分子を見つけるということは、たぶん、非常に重要なことだろうと。医学の、生命化学の分野で。そして、そういう分子を見つけて、どうして抗体ができてくるかという機構を明らかにするということは、生命科学・医学の研究で重要だろう。だからそういうことをやろうと。
実際にそういう分子が出ているかということを研究したわけですけれども。で、1973年にそういう分子が存在するということを発見して、それを論文で出したというのが、その今、最初のステップです。
高橋:最初なんですね。それは……。
岸本:それが、今、現在ではIL-6、インターロイキン6と呼ばれている分子なんです。
高橋:それは、たとえばその、T細胞とB細胞を一緒に…。
岸本:B細胞をだけを、まず試験管の中で培養しますね。そうすると抗体はできないと。Tリンパ球だけを。T細胞だけを培養しておいて、刺激して、その培養の上澄み液をここへ加えたら、そしたらこれが抗体を作りだすと。
高橋:ああ。すると、上済みの中に何か入ってると。
岸本:そう、上澄みの中に何かが入っているということを見つけた。それが先ほど言われたように、86年に、その分子がこれですよというのを明らかにしたということになるんですね。で、そういう分子が明らかに、構造が明らかになってみると、その次は出ますかね。
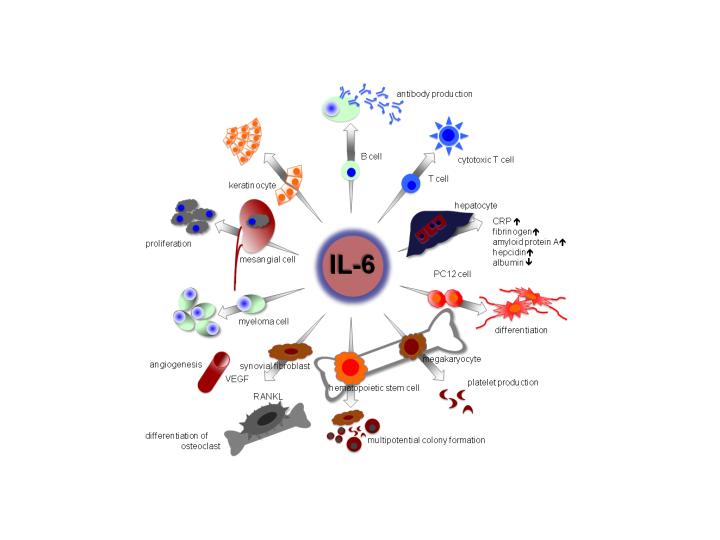
そうすると、我々はBリンパ球に働いて抗体を作らせるということで追いかけてきたんですけども、それまでにも世界中で、いろいろな機能をもつ分子が追いかけられていたわけなんです。たとえば、我々が肺炎を起こしたり、結核になったり、やけどをしたりすると、よく知られているのは、血沈が増えるとかそういうことがありますよね。
高橋:はい。
岸本:そういうことは、何かその場所からそういう何かが出て、肝臓の細胞に働いて血沈を増やす、上げるような物質が出てるというようなことを。それは何だろうかというのは研究されてたわけです。それは、それがそういう、もしや大事な分子だというのはもう、2000年前にヒポクラテスは、「病気とは血のにごりである」と言うてるわけですね。
高橋:おお。
岸本:血のにごりというのは、血沈とかCRP(C-reactive protein:C反応性蛋白)とか、アミロイドタンパクとかありますけど、そういう「急性期タンパク」と呼ばれる分子が出ることだと。その分子を出さすのも分子が何かあるというので、みんな研究してたわけ、80年代まで。
高橋:ああ、はい。
岸本:それも、この分子そのものだということが分かってきて、この分子は病気と非常に強い関係があるぞということが分かってくる。
それ以外にも、ここに書かれているようにいろいろな、骨を解かすことにかかわるとか、抗体産生細胞がガンになった細胞に働いてそれを増やすとか、腎臓の細胞に働くとか、いろいろな多種多様な働きがあって、病気と密接につながっているということが分かってきて、一気にこの分子の世界は広がるわけですね。
現在では、コンピューターなどで調べてみたら、6万以上のIL-6に関する論文が、世界中で出されてる。ということは、そういうふうないろいろな分野で研究されてきたわけです。
高橋:その作用する先は非常に多様なんですけれども、出しているのはT細胞なんですか?
岸本:いや、そうとは限らない。
高橋:限らないんですか?
岸本:T細胞も出す、マクロファージも出す、皮膚では皮膚の細胞も出す。関節では、後から出てきますけど、関節を覆っている滑膜からも出す。あらゆる細胞から出るし。
高橋:あらゆる細胞に作用を。
岸本:あるゆる細胞から出てあらゆる細胞に作用するという。最初がその、インターロイキンと白血球のあいだをつなぐというふうに使ってきたんですけれども、そうでなかった。あらゆる細胞から出て、あらゆる細胞に働く、体中の。
高橋:じゃあ、ちょっと名前を変えないといけないじゃないですか。
岸本:(笑い)そう。だから昔は、特異的なものというのが大事やけど、現在ではそういう幅広いものが大事やというふうに。
高橋:そうすると、最初の働きは、抗体を出す司令塔という位置付けですよね。
岸本:なってる。それを、我々がそれで追いかけてきたわけですけどね。
高橋:わけですよね。そうすると、抗体っていうのはヒトの体に入ってくる悪い抗原をやっつける成分ですから、いいもんであると。
岸本:いいもんだ。
高橋:ね。IL-6は正義の味方であると。
岸本:そうそう。
高橋:そう思いますよね。ところが、いろいろ作用が分かってくると、なんか、そうでもないっていう。
岸本:悪い方の働きの方が、非常に強く出てますね。
高橋:そっちの方が多いんですか。
岸本:IL-6という分子を作る遺伝子をなくしたネズミをつくりますね。IL-6のないネズミを。そうすると、ネズミがピンピンしてるんですよ。なんにも起こらない。他のものでたぶん代用されるんでしょうね。しかし、IL-6が大量に出るようにしたら、いろいろな病気になってくるわけです。だから、悪い方の働きの方が見えるんですよね。
免疫という働きは、疫、つまり病気を免れるんです。いちばん最初に言いましたように、インフルエンザから体を守る。ワクチンを注射することによって、感染、そういうことが起こらないようになるというような、それがなかったら生きていけないという。
高橋:はい。
岸本:しかしながら一方では、それがあるから花粉症にもなりますよね。それは「IgE」という抗体で、これは僕の先生であった、石坂公成先生の見つけられたものですけれども。
ですから、後からお話しする関節リウマチもそうですよね。いろいろな「免疫難病」と呼ばれる、たくさん難病の、何十種類もある難病のうちの多くは、その免疫が異常になることによって起こるんですよね。だから、守る働きと病気を起こす働きとは、もろ刃の剣。だからIL-6もそういうことで、抗体を作らせることに関与するといういい働きと、いろいろな病気を起こすという働きと、両方の働きがあるということですよね。
高橋:でも、そのIL-6が作れないネズミ、ピンピンしてるっていうのは不思議ですね。
岸本:たぶん他のもので代用するんでしょうね。しかしやっぱり、後から出てくると思いますけど、IL-6の働きを抑えて、関節リウマチや血管炎や、いろいろな病気を治すという治療をすると、やっぱり感染症にかかりやすくなりますよね。
高橋:やっぱりそうなんですか。
岸本:ヘルペスが出てきたり肺炎になったり、というふうな副作用も気を付けなければならないという。
高橋:やっぱり両方ある。
岸本:それは当然のことで、いちばん最初に抗体を作らせる分子として見つかってきたわけですから。
そしたら、他のものでも代用できるなら、なんのためにこれが後々まで残ってきたか。いちばんの理由は、「これは病気ですよ」と警告するためにあるんではないかと。
たとえばインフルエンザに感染するとしますよね。そうすると最初、熱が、ものすごく高い熱が出て、体がしんどくなって、鼻水が出て、白血球が増えてとか。そういうことは全部、このIL-6が最初にバーッと出てきて起こすんですね。それからその後で、そういう体の、熱が出たりとかいうことが、刺激。IL-6も刺激になって、抗体が4~5日したらできてくると。そしてウイルスは殺されるというふうになってる。しかし最初の、もし警告がなかったとしたら、病気になったということも分かりませんよね。
高橋:ああ、そうですね。
岸本:だから、警告のためにも大事な分子だということだと、僕は思うんですけどね。
高橋:IL-6って6番目っていうことですから、インターロイキンにはもっと他にもたくさんあるんですよね。
岸本:いろいろな種類の血液の中を流れてる白血球が、お互いに情報を交換し合う分子ですね。現在では30以上、名前のついた分子がありますけれども、やっぱり、いちばんよく目につくものから順番に見つかって、名前がついていったわけですね。
インターロイキン1というのは熱を出させる分子なんです。熱はどうして出るかということから研究されて、インターロイキン1が見つかった。
インターロイキン2というのは、Tリンパ球を増やす分子だということから見つかってくるというふうにして、順番に見つかってくる。
ところがいちばん多彩な、いろいろな機能をもっていて病気につながってたのが、6番目やったわけですよね。だからその6が、6番目に見つかったけれどもいちばん。いちばんて言うたらなんですけれども、よく知られているし、よく研究されているし、ということだと思うんですけど。論文がよく引用されるし、たくさん出てくるしという。
高橋:先生は、見つけられたときは、これほど重要なものとは思っていなかったと。
岸本:しかし、抗体を作らせることにかかわるということは、大事なことやと思ってましたよ。抗体がなかったら生きていけないわけですから、大事な分子だと思ってましたけれども、そういうほど広がりのあって病気につながってくるもんだとは、全然思ってませんでしたよね。
高橋:そうなんですね。それで、最も今、患者さんにとって朗報になっているのが、関節リウマチの薬として、これが使われるようになったということですね。
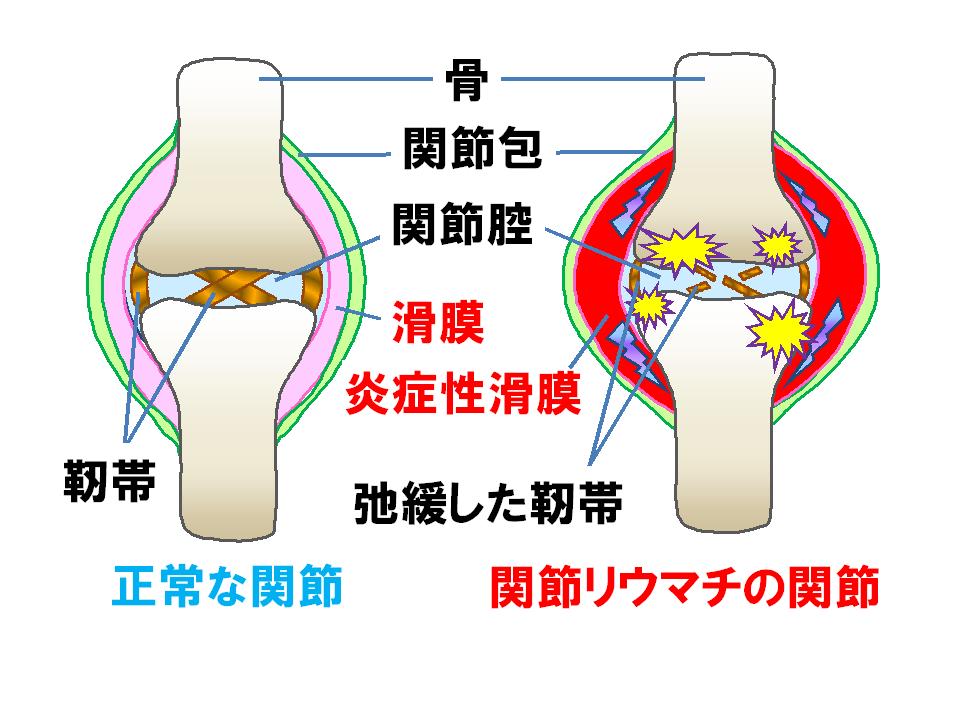
岸本:関節リウマチというのは、僕はリウマチの医者ではないですけれども、これが膝関節ですけれども、関節は滑膜という膜で覆われてるんですよね。それで、先ほど言いましたけれども、インターロイキン、IL-6はどこからでも出るわけですね。この滑膜からもたくさん出てくるわけです。
高橋:普通は出ないんですよね? 正常な方は出ないでしょ?
岸本:正常な方はそれが出てない。その理由は分からない。その理由が分かれば、なぜ関節リウマチになるかということが分かるわけですよね。それはたぶん、いろいろな、ウイルスが感染するとか、いろいろなことがたぶんあるんだと思うんです。それぞれの人にとって。
それと、いろいろ遺伝的な要素もある。というのは、日本人は全人口の0.5%ぐらい。しかし、外国人は1%。人口の1%の人がこれになるわけですね。そうすると、ここからこれが出るとこの滑膜も増勢してくるし、血管がどんどん増えてくるし。
そしてIL-6は、骨を吸収する細胞を作ってくるわけだね。だから骨が溶けてくるわけです。骨が溶けて、そうすると今度、溶けた骨はひっついてしまいますからね。で、関節が動かなくなると。で、大きな関節で動かなくなってきたら車いす生活になると。その次出して。
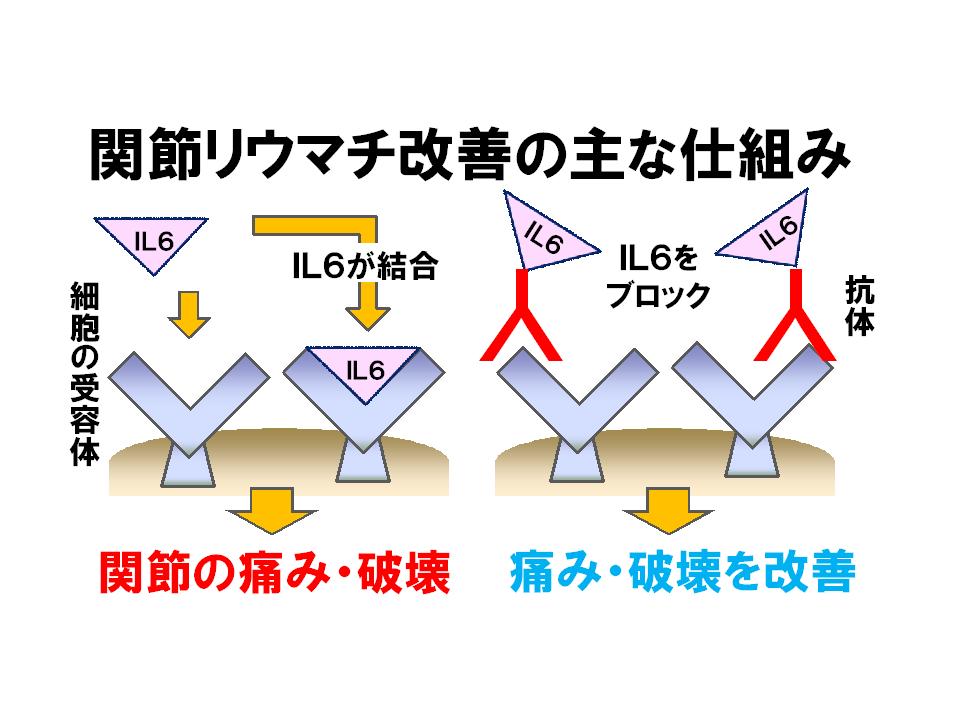
そうすると、このIL-6が働かなくしてやれば、その治療につながっていくんではないかと。IL-6という分子は、細胞のうえにある受容体にくっついて、そしてそこから信号を伝えて、いろいろな働きを起こすわけですよね。そうすると、これがここへくっつくのを防ぐような操作をすればいいと。それは、「受容体」と呼ばれる、これがくっつくところに抗体を作って、その抗体でこれがひっついてこなくしてやればいい。という発想ですね。それが1990年ぐらいから始めたことなんです。そして、その抗体ができて、それが現在、広く使われるようになってると。
高橋:要するに、IL-6がなぜ増えるかっていうところは、よく分からない。
岸本:分からない。
高橋:分からないけども、関節リウマチの方は、とにかく増えていると。で、増えていると、このIL-6は細胞の受容体にくっついて、そこからいろんな信号が細胞の中に行って、それで悪さをするいろんな細胞ができてくる。そのどこかを止めてやれば、悪さをする細胞は出てこないだろうというか。
岸本:悪さをする作用が消えていくだろうと。骨を吸収することもなくなるだろうし、熱を出さすこともなくなるだろうし、貧血になることもなくなるだろうし、いろいろなリウマチの人が。
高橋:症状ですね。
岸本:苦しむことは全て消えていくだろうと。だから、そのひっつくのをブロックしてやればいいということなんです。
高橋:なるほど。IL-6のブロックする抗体を作るっていうのは、大変だったんでしょうか。
岸本:抗体は、これは、ヒトの受容体に対する抗体を作るわけですから、ヒトで作れるわけはないですね。これはネズミで作るわけですね。それで今度は、そのネズミの抗体はヒトに与える、そのまま与えることはできませんよね。だからいちばん……。
高橋:そこをもうちょっと詳しく言いましょう。ヒトの抗体は、ヒトにとっては異物ではないから。
岸本:ないから。
高橋:抗体はできないわけですね。
岸本:ヒトに免疫して作れないわけですよね。
高橋:ええ。ヒトの受容体をネズミに入れてやると、ネズミはこれは異物だと判断して。
岸本:思うから、ヒトの受容体に対する抗体を作るわけですね。
高橋:はい。
岸本:ところが、その抗体は、これはネズミのタンパク質、で、抗体ですよね。
高橋:そうですね。
岸本:それをヒトに打つわけにはいきませんよね。
高橋:そうですね。今度はそれを人間は異物だと判断してしまうから。
岸本:そうそう、しまうから、だから、ヒトの受容体にもくっついて、しかも、抗体の大部分のところはヒトであるというふうなものに変えなきゃいけない。だから、そのくっつく部分のいちばん大事な部分だけ、何個かアミノ酸、配列を残して、あとは全部ヒトの抗体と入れ替えるわけなんです。それを「ヒト型化」というわけですけれども。そうすることによって、全然、ヒトにとって異物ではなくて、しかもヒトの受容体と結合するようなものができてくるわけ。
高橋:そこは、いろいろな試行錯誤があったんでしょうか。

岸本:それは、免疫学100年の流れを見てみますとね、最初の発見というのは100年前の、北里柴三郎とフォン・ベーリングという2人が抗体を発見するわけ。抗体の発見というのは、破傷風の毒素とか、ジフテリアの毒素を馬に注射したら、そうすると馬の血清は、そういう毒素を中和するものができてくるということを見つける。そうするとそれは、破傷風とかジフテリアというものは、毒素によって病気を起こしますからね、それはそれで治療になる。
最近でも震災でけがをして破傷風になると、馬で作った血清を打ちますよね。で、ベーリングは第1回のノーベル賞を1901年にもらうわけです。それは、ジフテリアの毒素に対する血清を馬で作って、そしてジフテリアにかかった子どもをたくさん救った。この時代はまだ抗生物質ありませんからね。
高橋:そうですねえ。
岸本:子どもの死亡率の、いちばんヨーロッパで高かったのはジフテリアの感染。ジフテリアの毒素が心臓の細胞に働いて、心臓をまひさせてしまう。
しかし馬の血清ですから、これ先ほどのネズミの血清と同じで人間にとって異物ですから、何回も打てないでしょ。それが順番に、抗体の構造はどうなっているか。それからそのモノクロナール抗体を作る。そして、ヒト型化の抗体を作るという技術が進んできて、そして、抗体医薬というものが作れるようになってきたわけです。
というのが100年の歴史。血清療法から、馬の血清を使って治療したことから、今そういうふうに抗体を薬にする。がんは、がんの細胞だけを殺して、体に影響を及ぼさなかったらいちばんいいわけですよね。
高橋:いちばんいいですね。
岸本:そうすると抗体というもの、もしそのがん細胞にだけ働く抗体が作れたら、そうするといちばんいいわけね。で、今それがたくさんやられていますよね。だから、100年たって、馬の血清からヒトの抗体医薬ということに免疫学は進んできたという。そのひとつの例として、リウマチのこういう薬も抗体医薬だと。
高橋:免疫学というと、普通はジェンナーの種痘の発見が始まりであると説明されることが多いんですけど、それはこれよりさらに100年ぐらい前ですよね。
岸本:そうそう。この100年前に、ジェンナーは種痘を始めます。
高橋:ええ。
岸本:その昔から、もう、それよりも何年も前からみんなが知っていたことは、天然痘にしろ何にしろ、伝染病はいったんかかったら、次はかからないということを知ってたわけですよね。
高橋:二度がかりなし。
岸本:二度がかりなしと。それはなぜなのかということの問いかけが、この北里とベーリングの抗毒素の発見なんですよね。最初はそんなこと何も分からんから、毒素でもちょっとずつ与えていったら、体は慣れてくるやろうと。
高橋:ああ。
岸本:それが免疫。そして調べてみたら、血液の中に中和するタンパク質ができてくるという発見につながるわけですよね。
だから、この前の100年、そういう経験。それから、それをちゃんと体系化したのはパスツールで、パスツールは弱毒化しておいた菌を注射したら、炭疽(たんそ)菌を注射したら病気にならないと。だから、予防注射という概念をつくるわけですよね。
種痘ちゅうのは牛の天然痘ですよね。それを注射するわけ。牛の天然痘というのは「ワクチニアウイルス」という。それに敬意を表して、予防注射は全部「ワクチン」と呼ぼうということになるわけです。
そうしたら、それはなぜ効くのかというのが、ここから始まってくるわけですね。
高橋:100年間は、なぜかは分からないけどとにかく効くぞと。
岸本:そうそう、効くぞという。いったんなったらかからないという知恵が、次には、積極的にかからないようにしようという、そういう種痘という現象からワクチンになってきて。そしたら、それはなぜなのかという働きから、抗体が見つかってきてということにつながってくるわけ。
高橋:さらに100年たって、それが遺伝子レベルでいろいろ分かってきた。
岸本:そうそう、解明。抗体の構造みな分かり、人を救って、そして今度、本式に病気の薬として使おうと。すると21世紀はやっぱり、抗体医薬が医薬の中心になってきますよね。
高橋:関節リウマチのお薬は、先生が発見された物質をブロックする抗体をお薬にしたもので、日本の製薬メーカー、中外製薬が開発したんですよね。
岸本:はい。
高橋:これは先生と中外製薬は、ずっと共同研究をされてきたわけですか。
岸本:中外製薬の研究者の人と、僕は昔からの友達。子どものときからの知り合いでもあった人で(笑い)。
高橋:たまたま。
岸本:阪大卒業の人がいると、たまたま。だから、そこから研究者が来てて一緒にしたから、そこへつながっていったんですよね。だけど最初、「日本で初めての抗体医薬」といいますよね。
高橋:ええ。
岸本:もう既に1990年ぐらいから、世界は、次は抗体が薬になるということを考えてやっているわけですね。ところが日本の製薬企業はどこも、分子量15万もあるようなタンパク質をうって、そんなもん薬になりますかいなというふうな考え方で、ずっと遅れてくるわけです。今になってみんな、抗体医薬がというふうに進みますけどね。だから、どこもやってこなかったんですよね。それが今、問題に。がんなんかは特に、特異的な抗体が役に立つと。
だから、いつも言うようやけど、高血圧とか、あるいはコレステロールとか、そういうものには非常にいい薬って、もう十分薬はあるわけですよね。ただ、治らない病気ということになると、がんであるとか、免疫難病であるとか、アルツハイマーであるとか、やっぱりそういうものにチャレンジしていく。そうすると、今、がんと炎症は、抗体医薬が非常に効果を発揮した分野になってきたわけですよね。
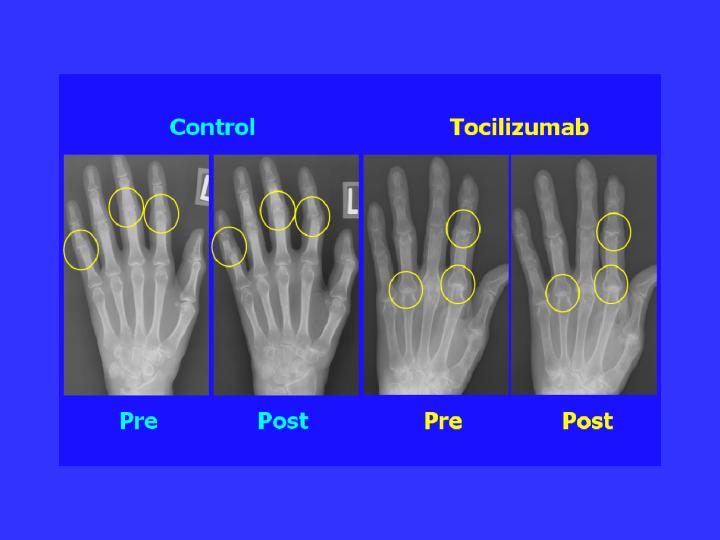
高橋:そのリウマチのお薬の効果を示すお写真があると思いますが、ちょっとそれを出していただけますか。
岸本:次ですね。たとえばこれはいままでの治療法で。
高橋:「Pre」っていうのは治療前ですね。
岸本:治療前ということですね。それが1年たったときに、たとえば指がこういうふうにして。
高橋:関節が曲がってしまってますね。
岸本:壊れてきますよね。みんなこうなっていく。骨が吸収される。そしたら関節が壊れる。
高橋:患者さんの指が変形しているのをよく見ますね。
岸本:そうそう。これは手の指ですけど、それが大きな関節で起こると歩けなくなってきますよね。
高橋:はい。
岸本:それからこれは、そこの抗体なんですよ。与えていくと、全然。1年たっても全く変化ありませんよね。
高橋:ああ。同じ指の形が保たれてるわけですね。
岸本:だから、早く見つけて早くそういうふうにすれば、全然、関節の変形なしでいけると。
高橋:この、従来の方も、従来のお薬を使ってらっしゃるんですか。
岸本:従来の薬、いままで何を使ってもろても結構ですという。
高橋:ああ、そうなんですか。それでもこうやって進行してしまったということですね。
岸本:そう、進行してしまうと。
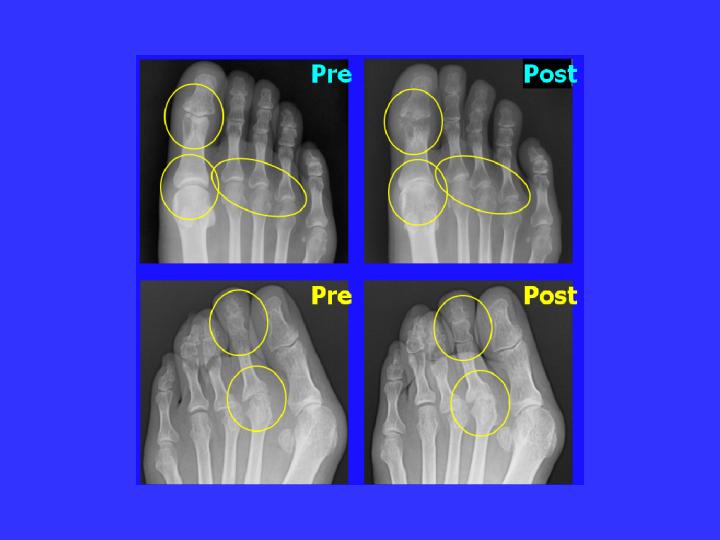
高橋:もう1つ写真がありましたかね。これは足の方ですね。
岸本:これも同じことですね。これも、いままでのやってた、こう、どんどんどんどん骨が。これは足の親指ですよね。
高橋:はい。
岸本:つぶれていきますよね。
高橋:え~と?
岸本:これが抗体を使ったやつですよね。それで、関節が壊れてこない。
高橋:この方、外反母趾(ぼし)なんですね。だけど、骨の関節の部分は、保たれてると。
岸本:保たれてる。どこも壊れてこないですよね。
高橋:そうですね。上の方はちょっとこう、傷になっていて、もう。
岸本:どんどんどんどんと、これは壊れてくるんですね。で、これが大きな関節で起こると、動けなくなって車いすになると。
高橋:そうなんですね。
岸本:新しい薬ができて、そういうことにならなくなったと。これから10年後、20年後で、リウマチで車いすになる人はいなくなるというふうにいわれてます。
高橋:これは、患者さんに喜ばれますよね。素晴らしい成果だと思いますね。
高橋:ここまでIL-6、インターロイキン6についてご解説いただきましたけれども、免疫研究では、日本人研究者の活躍が大変目立ちますね。これはなぜなんでしょうか。
岸本:やはり学問には伝統というか、それがあるんじゃないかなと思うんですね。免疫学の分野でみると、先ほど話しましたように、いちばん最初が北里柴三郎ですよね。抗体の発見。
高橋:はい。
岸本:それから花粉症。アレルギーの原因となるIgEの発見、石坂公成ですよね。それから、抗体がどうしていろいろなものを認識するようになるかという、遺伝子が変化するという利根川進は、これはノーベル賞になってますね。
高橋:そうですね。
岸本:そういうふうに順番につながってきてる。
高橋:石坂先生はアメリカでずっとご研究されていて、利根川先生も海外で。
岸本:外で、全部海外ですね。
高橋:海外に行ってもやっぱり、日本人という、なんか、つながりとかあるんですか?
岸本:それはありますよね。僕はそこへ行って、留学はそこでしたしね。
高橋:石坂先生のところですね。
岸本:石坂先生のところですしね。やっぱりそれはあると思うし、それから、やっぱりそれをもう。
たとえば僕は、また自慢話になったらいかんですけど、1990年代、論文がいちばんよく引用された人として、世界の15人の中に僕の名前、入ってますよね、IL-6がね。
高橋:はい、そうですね。
岸本:そうすると、そういう方向をめざして、世界でやっぱり評価されるようなというふうに、そこへ来る人はそういうふうに考えますよね。で、今、2000年代に入って、世界でいちばんよく論文が引用されたというのは、僕の弟子であった審良静男というのが免疫の世界で、やっぱりいちばんよく引かれるようになりましたよね。
高橋:はい。
岸本:で、僕の日本での先生の、山村雄一という大阪大学の総長だった人は、結核の空洞は死んだ結核菌を打ってもできるんやと。結核に対するアレルギーやと。遅延型のアレルギー反応。ツベルクリン反応もそうですよね。そういう免疫学ですよね。だから、そういうふうに3代が続いてきて。
高橋:大阪大学の伝統になるわけですね。
岸本:で、世界の免疫の拠点、世界拠点になってるし、3分の1は外国からの人が来てますからね。そういうふうな、やっぱり、師匠から弟子へ、またその弟子へというふうに伝わっていくんですね。
山村先生がいつも言われたことは、ノーベル賞級の研究をしても、それは教科書に1行残るだけと。しかしながら人を育てたら、それはまたその次の人を育てる。それで拡大再生産されていくと。だから人を育てなきゃならん。
いちばん大事なことは、僕はもう力を入れたことは、一生懸命、講義をするという。そうすると、いちばん前の方で一生懸命聞いてる人は、だいたい同じ考え方。波長が合うということですよね。共感するわけ。そうすると、そういう人が集まってきますよね。
高橋:ええ。
岸本:で、その中から優秀な人が出てくるわけですよね。で、同じような考えの人が集まってくると。
それは、局所的に大阪大学で。我々のところでみたときの、なぜ大阪大学で免疫学が発展してるかという、ひとつの局所的なもんですけど、日本全体としてみた場合でもそういうふうな、前からの伝統というものが影響してるんやと思いますけどね。
高橋:先生は、あくまで日本を根拠地にしてやってこられた。そこは、何か意図がおありだったんですか?
岸本:いや、別に。80年代の終わり頃、もう、ハーバードへ来ないかというふうななにもありましたけどね。どうするかと思いましたけれども、そのときに山村先生が言われたのは、日本で育ててもろて、それで、ようできるようになったら向こうへいてしまうんかと。日本のために。先生はもう戦前派ですからね、海軍のなにやからのもありますけど、日本のために働けというなにがありましたよね。
でまあ、そうとは限らないけれども、やっぱり日本で育てられて、大阪大学で育てられて、そして、そのために働くということは、よかったんやないかと思いますけどね。
高橋:一方で、最近、若い人が海外に行きたがらないっていうのを問題視する意見が強いんですけども、その辺は。
岸本:それはありますよね。行かない人が。
それはひとつは、考えてみると、僕の先生ね、石坂先生の時代、1960年代は、日本では何もできなかった。だから、石坂公成にしろ、花房秀三郎にしろ全部外国です。利根川進さんも向こうへ行きましたよね。僕らの頃でも、1970年代、日本とアメリカとのあいだには研究の環境設備、そういう点ではものすごい違いありましたよね。
高橋:はい。
岸本:今はどっちかというたら、1ドル80円台の時代になった。僕のときは1ドル360円ですよね。
高橋:そうですね、ええ。
岸本:80円台の時代になって、月給も下がりますしね。それから設備だって日本の研究室のやつは、ずっとアメリカよりええとこがたくさんありますよね。なにも行かなくたってできる。それは確かです。
それからインターネットとか、情報の発信のものすごい進みは、瞬時にして、同じ時間で情報が入りますよね。我々の頃は、ひと月遅れで雑誌が届いてくるという時代ですからね。だから行かなくたってできるんですよ。行かなくたって、同じ環境下に置かれるんです。
しかし、行くことと行かないことはものすごい違いがある。それは何かというと、単なるそういう情報とか設備とかそういうことやないんでね。人と人との付き合いなんですよね。人を知るということなの。いろいろな国の、いろいろな違った考えをもった、いろいろな人と知り合いになるという。知るということ。それは非常に大事なことですね。
僕も向こうにおった頃に、ドイツの人もおれば、イギリスの人もおれば、スペインの人もおれば、いろいろいましたよね。そうすっと、ドイツとイギリスは仲が悪い。いろいろけんかしますよな。
高橋:(笑い)
岸本:それから、イギリス人はスペインに、「おい、今日はシエスタもう済んだか」と。「昼寝したか」とかいうふうなバカにしますよね。
高橋:ええ。
岸本:そういうふうな、今になったらみんな仲ようしてやってますけど、そういういろいろな国の人と、いろいろな考えの違う人と知り合うということが、世界を広くするし。
それは何も、免疫学の分野だけやなしに、あるゆる分野で世界を広く知るということ。違った国がある、違った人がいる。それがものすごく大事やと思うんです。
それが科学も、やっぱり進める原動力。それが、今の人はあんまり行かないと。科学だけではなしに、自然科学だけではなしに、いろんな分野でそうでしょ? 日本が閉そく感をもってくると、ということになってきてますよね。それはあまりにも豊かになったから。
しかしまあ、だんだんだんだんと、いろいろなことが降ってきて、してくると、あまりにも豊かという。だから、若い人は元気がないとかだめだとか言うたけど、こういう事態が起こってるとき、やっぱり若い人、頑張ってますよね、そういう。
高橋:ああ、大震災ですね。
岸本:大震災のときに頑張ってますよね。
高橋:ボランティアに行きたいとかね、たくさんいらっしゃる。
岸本:だから、あまりにも豊かな環境がそういうふうにしてたんで、そうでなくなりゃ、やっぱり頑張ると。能力出すんじゃないかなと思いますけどね。
高橋:現状が非常に快適ですから、若い人にとって、ね。
岸本:そうそうそう、あまりにも快適すぎる。
高橋:頑張るぞっていう気持ちになれないです。いわゆるハングリー精神をもてって言ったって無理な環境にあるわけですよね。
それと一方で、研究していることがすごくいいことなんだっていう、そういうロールモデルですか? そういう方たちが、目立ってないっていうところもあるように思うんですけどもねえ。
岸本:それは僕、最初に言いましたけれども、役に立つ研究せえとか、日本からは医療に役立つようなものがあまり出てないとか、医療推進のイノベーションだとか、わーわーわーわー、掛け声だけは進めますけどね、そういう意味で、着実にきっちりしたことを積み重ねていけば、ちゃんとこういうことにもなるんやと。
これは、言おうと思いますけどブロックバスター。薬でブロックバスターというのは、1000億円以上の市場になるものをいいます。そういうものにたぶんなっていくわけですけれども、そういうふうなことにつながるんだという例を示せたということは、やっぱり、いろんな人、若い人にも刺激になっているし、と言いますね。
この前どっかで講演したときに、若い人が、非常に基礎的な研究から、しかもそれが薬につながって、しかも今また、なぜそれが効くのか、なぜそういう病気になるのかちゅうとこへ、我々の研究は進んできてるわけですけれども、「そういうのを聞いて、鳥肌が立つような思いがしました」という感想を言うてくれた人もおりましたけれども。で、せやからロールモデルを示すということは、僕は非常に大事だと思うんです。
先ほどいいましたけども、IL-6の信号が伝わらないように受容体をブロックする抗体を与えてるわけですね。だから、たくさん増えてきてるIL-6を中和してるわけやないわけですね。
高橋:はい。
岸本:ところが、たとえばリウマチの患者に、これをひと月に1回ずつ注射していくわけですけど、だんだんだんだん良くなってきた人は、血中のIL-6の濃度もだんだん下がっていくんですよね。
高橋:ほ~。
岸本:ということは、IL-6の信号をブロックするということは、根本的に最初に異常だった何か。根本的な免疫の異常を矯正してる。治しているということになっていくわけですね、本当の意味での。単にその症状をとってるんではなしに、根本的に治していってると。それはどういうことなのか。なぜ、IL-6が異常に出るようになるのか、というふうな問題に。
高橋:その、謎だった部分にも。
岸本:もとへ戻って、そういうことにつながってきて、それが今この4~5年、もう1つ別の細胞があってどうとかこうとか、とかいうのにつながってきてるわけですけれども、だから、いつまでもこういうこと続けてる(笑い)。
高橋:研究が続くんですね。
岸本:そうして、そういうことを続けてると、今でもまだやってるんですよということを示すことも、ひとつのその、先ほどいわれたロールモデルというものが。
高橋:そうですよね。先生は現役の教授でらっしゃるんですよね。総長もおやりになった。まあ、名誉教授の肩書きもお持ちで、で、なおかつ現役。これはすごいことですよね。
岸本:やっぱりそれはおもしろいから、という何がありますよね。おもしろいこともあるし、そういうふうにして、若い人の、いつまでも続けてやると。そうして、何か新しいことを次、見つけていくということを続けるんですよというモデルに。モデルちゅうか、みんながそれを、そういうふうに感じてくれればいいと思いますけどね。
高橋:先生、これは薬になるということは、いつ頃から意識されたんですか?
岸本:せやから、1990年の初め頃、いろいろな病気とつながってるということが分かってきますよね。
高橋:分かって、はい。
岸本:リウマチだけやなしに、多発性骨髄腫もあるし、いろいろな病気につながってるということが分かった。そうすると、その信号をブロックしてやれば、ひょっとしたら薬になるかも分からんと。そうすっと抗体を作ればいい。その頃から、抗体を薬にしようというのは世界的な流れとして始まってきてましたからね、抗体をヒト型化するとかいうことが。
高橋:はい。
岸本:だから、そういけるんではないか。今、日本で、役に立つ研究をせよとか、「トランスレーショナルリサーチ」。トランスレーショナルリサーチというのは、基礎的な研究を。
高橋:臨床と。
岸本:臨床につなげるようなことをせよというけど、日本ではそれがあまり。
高橋:弱いと。
岸本:どうしても弱いと。
高橋:はい。ずっといわれてます。
岸本:そんな掛け声がいわれてますよね。それは、僕のがなぜいったかということ。僕は基礎的な研究から、内科の教授もしましたよね。それからまた基礎的な研究。
高橋:お一人でトランスレーショナルリサーチ、やってらっしゃるから(笑い)。
岸本:そうそう。だから、そのあいだをずっと、IL-6が一緒について動いたから、基礎から臨床へ、そして臨床からまた基礎へというふうにつながる。できるんですよね。
日本では、基礎的な研究をしている人と、そういう、病気のことをやってる臨床のお医者さんとは、全然、交流が少ない。
高橋:バラバラなんですよね。
岸本:バラバラちゅうのが問題なんだ。
高橋:そうですね。
岸本:アメリカでは、1つの内科の教室の中に、いろいろなそういう基礎的な研究をしている人もおれば、臨床をやってる人もおると。そういうことで、たとえば白血病の細胞に対する抗体を作って、というふうなことをやってる人もおれば、一方では白血病の治療で骨髄移植をしてる人もおると。
そうすると、この抗体を骨髄移植のときに使ってみようか、というふうなことからできてきたわけですよね、白血病の抗体医薬も。だから、そういうふうな連携がうまくいってないと。1つの中にいろいろな多様性がないということも、いい基礎的な研究もあるのに、つながってこないひとつの原因かもしれませんよね。
高橋:そうですよねえ。
岸本:それと、製薬の会社と大学とも、またこう、つながりが少ないですよね。
大きな薬だって、外国は、製薬会社の研究所から生まれてくるんではなしに、大学からの研究から生まれてきたものが、それが製薬業界へ、製薬会社へ移されて作られてくるわけで、そういう間のつながりも少ない。とかいうふうな問題もありますよね。
高橋:その場合にね、日本の大学は、ベンチャー企業をもっとね。
岸本:そうそうそう。
高橋:自ら興すべきだ、っていう話がかなり前から出てますけれども、その辺は先生はどうですか? 日本もそういう形にもってった方がいいですか?
岸本:なかなかそれはうまくいかないね。
高橋:うまくいかないんですか。
岸本:ひとつは、どう言うかな。日本の人となりは、「寄らば大樹」というなにがありますからね。それはなかなかそういう、独立してっていうんのも少ないし。
高橋:一方で、日本にもそこそこ大きな製薬会社ありますけれども、でも、多国籍企業と比べると、もう雲泥の差の力ですよね。
本当は、薬を作るというような企業は、これからの時代、エネルギーをあまり使わずに、価値の高い製品を作っていくっていう点で、非常に期待がもてる産業だと思うんですね。日本みたいな国こそ、そういう産業が大きく発展してほしいとも思うんですが、日本の今のメーカーの様子みてると、ちょっと心配だなっていうところもあるんですけれど。
岸本:薬というのは、いちばんの知的集約の産物ですよね。それでそういう、資源もない国の、しかも頭のいい、ものすごく教育水準、研究水準の高い国ですからね、それが進んできていいはずなんだけれども、それがなぜなのかという(笑い)、ことですよね。
高橋:ええ。
岸本:それはやっぱり大学と、全体にいえることは外との交流が。世界的な観点での交流が少ない。
今、なにがいちばん、どこへ向かっていくのがいちばんいいのかというところの取っつきが、ちょっと遅れるんですね。ちょっと遅れて後を追うという、流行を追うというぐらいでね。
高橋:それは大学も会社も同じ…。
岸本:大学も会社もちょっと遅れて。そやから、抗体医薬っていって、今になってからワーワー言うてますよね。
高橋:ええ、ええ。
岸本:しかしやっぱりこれは、技術の積み重ねも必要なんですよ。だから急には行かないから、外国のベンチャーを買いにいったりとか、いろいろなこと。
せやからそれはやっぱり、世界での人の交流、みんながなにを考えているかという交流が少ないんやないかなと。研究も同じことであって。だから、外へ出て行くこと。単に、設備やとか環境やとか給料やとか、そういうことやなしにね、外へ出て行くこと。外と交流し合うこと。ということの重要性ですよね。あらゆる分野で。
高橋:薬会社に就職した方もまた大学に戻ったりとか、そういう人的交流もね、もっとあった方が。
岸本:そうそう。それも大事、それも非常に大事なことであって。
高橋:ようやく最近、少しずつそういう例が出てきたっていうぐらいですよね。昨年ノーベル化学賞を受けられた根岸先生は、あの当時は、民間にいたら大学に帰るなんて、日本では考えられなかった、だからアメリカに行って研究したっておっしゃってましたね。それは、日本のアカデミアの問題点。
岸本:外国の会社の、製薬のいちばん上の方は、みんなが大学の医者ですよね。日本の製薬会社で医者がいるというたら、診療所のお医者さんやった。
高橋:アハハ。
岸本:薬を作るのに、病気を知っている医者がおらないで、どうして薬が作れますかという、ね。そこのところにも大きな問題があったわけなんですよ。
ドイツでも、そういう研究者のいちばん世界的にも有名な人が、皆、会社のそういうところへあれしてますよね。そして何をすべきや、何を作るべきやという発想がね。
高橋:そうですね。先生はIL-6一筋で来られたから、そこからさらに広い視野が開けてきたって、そんな印象を受けましたけども、振り返ってみていかがですか?
岸本:そうですね。僕はやっぱり継続が。僕の座右の銘は、「継続が創造を生む」と。ひとつのことをやっぱり、続けていくということは大事ですね。いろいろなことができるけれども、それはやらない。僕はいつも人にも言うのは、何をやるかというのではない、何をやらないかということが大事やと。
高橋:ああ。
岸本:だんだんと、大型の研究費とかいうのが増えましたよね。そういうことは、その研究者をスポイルする。なんでもできる。そやから、これもやってみい、これもやってみい、この遺伝子を消したネズミをつくれ、これをせいとか、手を広げますよね。手を広げていくとだんだん薄くなっていくというか、創造的なことができなくなる。昔のお金のなかった時代の方が、そしたら、何がいちばん大事か、何をするか、どこへ集中するかということを考えますやん。
高橋:そうですね。
岸本:で、考えないでワーッとできるという。だから大型の研究費、何億円とか何十億円とか、1人の人にやるっていうのは、医学・生命科学では、僕はマイナスやと思いますけどね。
高橋:そうですね。せっかく研究費が増えたもの、それを効率的にというか、本当にいい形で使ってって。
岸本:そうそうそうそう。
高橋:日本の国力を上げるように使われていくといいですね。
本日は、岸本忠三先生にお話を伺いました。「科学朝日」、今回はこの辺で失礼します。
有料会員の方はログインページに進み、朝日新聞デジタルのIDとパスワードでログインしてください
一部の記事は有料会員以外の方もログインせずに全文を閲覧できます。
ご利用方法はアーカイブトップでご確認ください
朝日新聞デジタルの言論サイトRe:Ron(リロン)もご覧ください